Aujourd’hui nous retrouvons Gaëtan Henry en réponse à la relecture indépendante de Mr Trudelle Pierre faisant suite à l’article suivant: “Thérapie Manuelle vue par les preuves” : 1- Hypothèses biomécaniques, publié par Kinéfact. Au vu de la réponse rapide et à charge de Mr T, Gaëtan s’est proposé d’émettre une réponse très développée. Nous vous recommandons vivement de lire la première série d’article de Gaëtan avant de s’atteler à celui-ci
Amis de la lecture critique d’article longue et fastidieuse, bonjour.
En avril 2020, j’ai eu l’opportunité de publier sur le site de Kinéfact une série de 3 articles sur la thérapie manuelle. À cette occasion, de nombreuses critiques positives ont été formulées. Toutefois, un kinésithérapeute et gestionnaire d’organisme de formation, Mr Trudelle Pierre a rédigé en deux jours, une critique du premier article de la série. Il m’a semblé nécessaire d’y répondre et je remercie l’équipe de KineFact qui me permet de rendre visible cette réponse.
Je tiens aussi, avant de commencer, à remercier Pierre Trudelle pour le temps passé à rédiger sa relecture, certaines de ses remarques et études citées auront été constructives et m’auront permis d’améliorer l’article et mes connaissances sur le sujet.
J’ai rédigé, avec méthode, une réponse exhaustive, article par article. Vous y trouverez aussi, mises en avant, les différentes modifications que j’ai pu faire sur le premier article.
Au total sur les 64 études que j’ai pu citées, seulement une seule n’était pas pertinente pour son appel dans le texte bien qu’elle aurait confirmé mes propos dans une autre partie du texte. 11 études auraient mérité une présentation plus approfondie afin de de clarifier mon texte. Pour ce qui est des 29 études apportées par Mr Trudelle dans la réflexion, seulement 5 sont pertinentes et apportent du contenu par rapport à leurs appels dans le texte, les autres sont hors sujet. Il est important de noter que ces 5 études vont dans le sens des propos rapportés dans l’article.
Il me paraissait aussi essentiel de souligner trois points avant de commencer cette réponse exhaustive :
Mr Trudelle a notamment formulé le reproche de ne pas déclarer mes conflits d’intérêt et ceux des différents relecteurs, dont le nom était signalé, ce que l’on ne retrouve pas forcément dans une Peer Review. Pour ma part je n’ai ni lien ni conflit d’intérêt, il est regrettable et très étonnant que suite à cela Mr Trudelle n’ait pas déclaré les siens lors de sa relecture.
Mr Trudelle considère aussi qu’il n’est pas recevable d’inclure des études qui n’ont pas été effectuées par des physiothérapeutes. C’est un argument qu’il a maintes fois utilisé pour justifier le fait de ne pas analyser certaines des études citées. A ce titre pourquoi ne pas prendre en compte seulement des études de kinésithérapeutes français puisque la formation d’un pays à un autre diffère, ou encore ayant réalisé un cursus post diplôme particulier, tant les pratiques intra-professionnelles semblent varier ? Sur tous les articles sur la thérapie manuelle qui ont été cités ou lues pour la réalisation de cet article, aucun n’a spécifiquement dans sa revue systématique ou narrative ciblé une profession en particulier. Ostéopathe, kinésithérapeute, chiropracteur, médecin, nous partageons des compétences communes et il ne semble pas logique et intéressant, d’un point de vue scientifique de ne s’en tenir qu’à la lecture d’article de confrère de même profession pour discuter de thérapie manuelle, d’autant plus si les termes évoqués sont décrits de manière similaire dans les études.
Les articles de validité palpatoire nécessitent une imagerie pour confirmer la palpation, il est donc tout à fait normal que des médecins puissent être présent dans l’étude, de plus la palpation est un champ qui intéresse fortement les médecins pour le diagnostic ou encore pour permettre d’infiltrer le plus précisément possible en l’absence de contrôle radiologique. L’étude de Kim qui n’a pas été lue par Mr Trudelle car faite par des médecins ne porte même pas sur la palpation mais sur la concordance radio de la ligne EIPS vis-à-vis d’un étage vertébral particulier afin de confirmer ou d’infirmer la règle palpatoire EIPS en regard de S2.
Enfin, parfois Mr Trudelle a signalé n’avoir lu que le résumé des études que j’avais pu citer ce qui est fortement préjudiciable sur la qualité de son analyse sur les articles en question.
A l’issue de cette réponse vous aurez une connaissance de fond sur les différentes études citées.
Chaque ligne, chaque donnée du premier article sont maintenues, détaillées et expliquées par cette analyse exhaustive qui je l’espère ne vous découragera pas par sa longueur. Bonne lecture.
Avant propos: Bien que l’usage du “nous et du “on” ont été employés, cette réponse a été effectuée et rédigée exclusivement par Gaëtan Henry.
Aide à la relecture: Marguerite Dontenwille, Bryan Littré, Robin Vervaecke, Joshua Lavallé, Yvan Sonjon, Théo Chaumeil et Anthony Halimi
Cette partie est l’analyse détaillée et critique de l’ensemble de la littérature que j’ai pu citer dans mon premier article ainsi que celle de Pierre Trudelle dans sa relecture.
Dans cette réponse analytique à Pierre Trudelle, il sera question de :
- Corriger les erreurs : celles relevées par M. Trudelle, ainsi que celles qui lui ont échappées et qui ont été relevées lors de la relecture de l’article en vue de cette réponse ;
- Préciser les imprécisions qui ont donc pu être sujettes à interprétation de la part des lecteurs ;
- Compléter et approfondir les notions à la lumière de données n’ayant pas encore été avancées dans le débat ;
- Discuter, à la lumière de ces 3 premiers points, de la validité de la critique générale apportée par M. Trudelle
Pour ce faire la présentation de l’article se fera comme telle : La trame suivra celle du premier article, je commenterai les différentes études citées dans ce premier volet ainsi que celles proposées par Mr Trudelle. Si des modifications de certains passages du premier article s’avèrent nécessaires, celles- ci seront mises en avant en rouge.
Pour éviter toute confusion, Mr Trudelle sera cité en marron et l’article de Kinéfact en bleu. Il en sera de même pour les études : en marron celles citées par Mr Trudelle en bleu celles citées par moi même.
La méthode de cet article est la suivante : J’ai réalisé à nouveau une lecture critique de toutes les études que j’ai eu l’occasion de citer dans l’article.Les études citées par Mr Trudelle ont été relues elles aussi . Afin de nourrir l’argumentaire j’ai également effectué une recherche par “Snowballing” c’est-à dire la recherche de nouveaux articles via les citations d’études et via la lecture des références de chaque étude. Une équation de recherche a été mise en place pour chaque thématique. Par exemple, pour la partie : association mobilité symptômes, les mots clés utilisés étaient les suivants “ spinal stiffness”, “segmental stiffness”, “lumbar stiffness”,“passive accessory intervertebral movement test”, “palpation”, AND “hypomobility” OR “hypermobility”AND “pain” OR “symptom” OR “disability”.
Cette analyse ne concerne que le cœur de l’article, c’est-à-dire les 8 chapitres découlant de l’approche du rasoir d’Occam que j’ai auparavant explicité.
- Association mobilité-symptôme
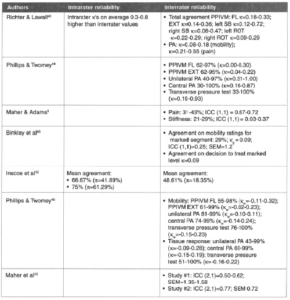
Etude de Branney2014 :
C’est une étude de cohorte réalisée par des chiropraticiens. Nous ne reviendrons pas sur ce que nous pensons de la discrimination de Mr Trudelle sur les articles issus de cette profession.
30 sujets sains et 30 sujets symptomatiques (région cervicale), avec des caractéristiques démographiques comparables à la baseline ont reçu des examens de fluoroscopie quantitative afin de mesurer la flexion et l’extension cervicale à la baseline, et à 4 semaines de suivi. De nombreux objectifs ont été déterminés dans cette étude, dont voici les principaux :
Le critère de jugement principal était l’amplitude intervertébrale. Les patients symptomatiques ont reçu 12 séances de manipulation vertébrale sur 4 semaines.
Voici un résumé du schéma de l’étude illustré ici :

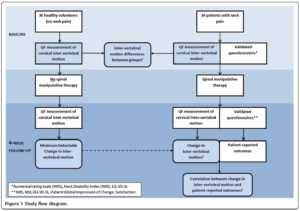
Cette étude a permis de faire ressortir les résultats suivants :
- Il existe des articulations entre les vertèbres, qui bougent moins que les autres dans les cervicales
- Il y a autant de vertèbres bougeant moins chez les personnes qui ont mal que chez les personnes asymptomatiques
- A mains nues on ne semble pas pouvoir les identifier
- Manipuler permettrait d’augmenter la mobilité des vertèbres mais pas forcément de celles qui bougent le moins
- Les douleurs s’améliorent sans rapport avec l’augmentation de la mobilité
Cette étude est donc conforme à nos propos rapportés dans l’article : Il n’existe pas de différence significative entre la perte de mobilité segmentaire et la présence de douleur cervicale (Branney 2014) Une coquille était placée ici, nous avons remplacé le terme “lombaire” par “cervical” A la question suivante posée par Mr Trudelle : « Pourquoi avoir choisi cette étude pour évaluer l’association mobilité et symptôme alors que cette étude évalue l’impact des manipulations sur des segments qui ont quasiment la même mobilité que pour les sujets sains ? »
L’étude montre bien qu’il n’y a pas de différence de mobilité entre sujets sains et sujets symptomatiques, c’est l’une des questions posées par l’article.
Etude de Jordan 1997 : Mr Trudelle nous renvoie sur cette étude pour discuter sur le même sujet de la région lombaire (en lien avec la coquille dans notre phrase).
Nous ne comprenons pas ce que pourrait apporter l’étude de Jordan, car en effet celle-ci traite aussi de patients cervicalgiques et non lombalgiques. Celle-ci cherche à comprendre les différences sur certaines variables entre une population saine et une population symptomatique. Il est à noter qu’il ne nous a pas été possible de nous procurer l’article en entier. Basés sur la lecture du résumé, nous formulons avec prudence que celui-ci ne semble pas avoir pris en variable de contrôle la mobilité segmentaire passive ni régionale, mais la mobilité active ainsi que la force musculaire, ce qui est hors-sujet.
L’article cité dans la relecture de Mr Trudelle semble ne pas être pertinent.
A la suite de cela, Mr Trudelle cite des enseignants de son organisme de formation sans aucune référence.
Etude de Rubio-Ochoa 2016 : Cette revue systématique proposée par Mr Trudelle a pour objectif de déterminer la validité (précision diagnostique) et la fiabilité (reproductibilité) de tests cliniques pour diagnostiquer des céphalées cervicogéniques.
La validité ici n’est pas déterminée par un quelconque défaut de mobilité, mais par la présence ou non d’une céphalée cervicogénique en réponse aux tests cliniques (reproduction des symptômes).
Ce qui est intéressant, c’est que lorsque l’on se penche sur la méthode des études incluses dans cette revue, on observe que les tests PAIVM (Passive accessory Intervertébral Movement) employé dans ces études sont décrits ici pour la recherche de reproduction de symptômes et non d’une quelconque appréciation de mobilité contrairement à ce dont il était question de discuter dans mon article (pour rappel la mobilité) :
« Each vertebra was tested a maximum of two times, in an attempt to minimise a mobilisation effect of the test procedure, in an effort to maintain subject consistency for the second examiner. A negative response was no pain on firm pressure. A positive response was to elicit pain, particularly when the patients’ exact symptoms were reproduced. The symptomatic segment was defined as the vertebral level where pain was provoked to the strongest extent, or most reproduced the patients’ symptoms » (Hall 2010, l’une des études inclue dans la revue systématique).
L’étude citée par Mr Trudelle n’est pas pertinente car l’étude ne porte pas sur des tests évaluant la perception de mouvement.
Etude de Karas 2016 : Mr Trudelle, inspiré, nous propose une autre étude sur ce sujet, celle de Karas et al. Cette étude qualitative cherche à analyser la relation entre la confiance dans certaines techniques manuelles et le niveau de connaissance des thérapeutes au sein de IFOMPT. Les auteurs mettent en évidence dans leur introduction le manque de validité et de fiabilité dans les techniques palpatoires et de traitements manuels spécifiques comme les PAIVM, ce qui est en accord avec les affirmations faites dans mon article :
« While some research has shown that experienced physical therapists and manual therapists (MTs) can reliably repeat static palpatory findings in the spine, the inter-therapist reliability is often poor. » ou encore « Techniques such as passive physiological intervertebral motion (PPIVM) and passive accessory intervertebral motion (PAIVM) are frequently used to allow MTs to dynamically assess spinal motion segments. The results of these assessment techniques, along with a variety of additional information, guide the therapist’s clinical decisions.12,13 While these techniques are commonly taught in manual therapy education, their lack of validity and reliability has not gone unnoticed. »
Les auteurs soulignent que 98% des thérapeutes manuels utilisent l’évaluation de mobilité segmentaire dans leur bilan et pensent que celle-ci est valide : « Étant donné le manque apparent de preuves solides concernant la validité et la fiabilité de l’évaluation du mouvement intervertébral, il devient difficile de savoir comment les MT développent leur confiance en exécutant des compétences cliniques manuelles avec la connaissance de la littérature disponible » (Traduction personnelle)
« Nous avons spécifiquement évalué deux questions de recherche principales : (1) La confiance dans l’évaluation manuelle de la colonne vertébrale est-elle associée au degré de familiarité rapporté d’un MT avec la littérature ? (2) Les prédicteurs de confiance dépendent-ils de la région vertébrale à laquelle la technique est appliquée ou de la technique spécifique employée ? » (Traduction personnelle)
L’étude de Karas est extrêmement intéressante, vous pouvez ici voir deux questions, l’une se rapportant à la confiance dans la palpation statique lombaire, et l’autre se rapportant à la perception de connaissance de la littérature sur le sujet. Celles-ci sont quantifiées à l’aide d’ une échelle de Likert.

Les auteurs ont rapporté que plus la sensation d’avoir des connaissances sur le sujet était forte, plus la confiance dans la technique l’était aussi.
Les auteurs ont souligné dans leur discussion que ce résultat était très étonnant compte tenu de la littérature sur ce sujet. En effet, avec une réelle connaissance du sujet, les thérapeutes auraient dû être moins confiants sur leurs capacités palpatoires et de précision dans leurs techniques.
Ce qui fait questionner les auteurs sur la littérature lue par les thérapeutes et sur les données qu’ils reçoivent sur le sujet ou qui retiennent leur attention et surtout, comment ils interprètent la littérature : « Although we did detect a relationship between use of the literature and confidence, in order not to bias the results of the study, we were unable to specifically determine how each respondent interprets the literature, that is, whether they interpret it to support or refute the given technique. In addition, we did not attempt to determine what types of literature the respondents read and were basing their answers upon. It may be that respondents were well read in palpatory models that have not been validated. While this distinction is important, we did not believe we could determine one’s ability to critically review and appraise the relevant, current literature. »
Aurait-on affaire ici à un biais de sélection ou à un effet Dunning Kruger des sujets ? Peut-être les deux, mais les organismes dispensant des formations en thérapie manuelle devraient à ce jour, montrer toutes les données permettant aux participants d’avoir un avis plus actuel,en phase avec les observations faites de manières contrôlées.
Cette étude bien qu’intéressante et en lien avec notre sujet n’est pas pertinente pour justifier son appel de référence par Mr Trudelle, on ne voit pas en quoi celle-ci peut justifier son argumentaire.
Cette étude est en revanche en accord avec le propos général de la série d’articles.
Suite à cela 5 études sont citées de la manière suivante par Mr Trudelle: “Si l’auteur cherche des études où des physiothérapeutes ciblent un traitement articulaire rachidien lombaire pour traiter une hypomobilité, il est possible de citer Ford 2019 (13) pour un traitement ciblé du lombalgique sur des hypomobilités, ou une étude sur la concordance de l’évaluation sur le sujet comme celle de Hidalgo en 2014 (14) ou de Maher en 1994 (15). Il existe des études de sensibilité et spécificité avec bloc anesthésique pour étudier la spécificité comme celle de Phillips en 1996 (16) ou sur le choix stratégique hypo ou hypermobilité et le traitement adapté comme celle de Fritz en 2015 (5). C’est difficile de proposer des articles lorsque l’on ne sait pas ce qui recherché spécifiquement ici.”
Analysons les:
ECR de Ford2019: Cette étude porte sur un sous groupe de patients lombalgique. Elle compare l’efficacité d’un traitement manuel, associé à du contrôle moteur et des conseils patients centrés basés sur différents facteurs psycho sociaux, sur 10 séances, comparé à deux séances de conseils. Les critères de jugement ne portent pas sur la mobilité mais sur la douleur et la fonction. L’étude n’est pas adaptée au sujet traité, il est impossible d’une part d’isoler ici l’efficacité ou non du traitement manuel puisque que l’on retrouve aussi dans le groupe interventionnel d’autres traitements non présents dans le groupe comparateur. Et de plus, de comprendre par quels effets, biomécaniques ou non, ce traitement manuel aurait pu être efficace, de part l’absence de critères de jugement appropriés pour cela.
Etude diagnostique de Hidalgo2014: Cette étude porte sur la clinimétrie de différents tests actifs et passifs dont les PAIVMs. Les auteurs ne se basent ici que sur la reproduction de symptômes douloureux, nous n’avons pas d’informations sur comment ont été objectivés les différents étages vertébraux (palpation ? contrôle radio ?) ce qui pose un réel biais sur l’interprétation des données.
L’étude n’est pas adaptée au sujet traité.
Etude diagnostic de Maher1994: C’est une étude portant sur la fiabilité du test de PA segmentaire sur deux paramètres: la reproduction de douleur et la sensation de raideur perçue. L’accord inter-évaluateur était faible pour la sensation de raideur perçue et il n’y avait aucun contrôle radiologique afin de s’assurer de la précision palpatoire des différents étages. Cette étude n’est pas pertinente pour son appel dans le texte. Les résultats en revanche confirment les propos que j’ai pu rapporter dans une autre partie de l’article, à savoir la faible fiabilité de ce type de manœuvre.
Etude diagnostic de Phillips1996: C’est une étude de fiabilité et de validité portant sur la capacité des thérapeutes à incriminer par des tests manuels (PAIVMs PPIVMs) un étage symptomatique, comparée à un gold Standard ( bloc anesthésiant sur la structure incriminée).
Outre le fait que l’on ne connaît pas en détails les moyens d’évaluation permettant d’incriminer la zone à infiltrer, l’étude n’analyse pas la mobilité vertébrale via un Gold Standard. D’une part l’association mobilité symptôme n’est pas étudiée d’autre part les valeurs clinimétriques en l’absence d’indications verbales des patients ( provocation de douleur ou non à la palpation) sont modérées seulement et pourraient être expliquées par des facteurs confondants comme l’imprécision du bloc anesthésiant , les suggestions verbales, la dissociation radio clinique, etc…
Cette étude n’est pas pertinente pour son appel dans le texte.
Etude de Wong2017: L’étude de Wong 2017 est une étude narrative, elle souligne que l’interprétation de la validité et de la fiabilité des techniques de perception de mobilité est souvent confondue entre technique instrumentale et manuelle. Cette affirmation est en partie erronée, Snodgrass en 2012 différencie déjà les deux dans son interprétation. Pour justifier l’hétérogénéité des données, Fritz le fait aussi en 2011 (Snodgrass2012, Fritz2011).
Elle se penche aussi sur l’association entre la mobilité et les symptômes et cherche à savoir si ce principe fondamental utilisé comme justification à la recherche et au traitement d’une “hyper/hypo mobilité” est valide ou non.
L’étude de Wong a été citée dans un premier temps car elle pose bien le contexte de la place de l’évaluation de la mobilité segmentaire en thérapie manuelle: « Of various physical examination procedures, posteroanterior (PA) segmental spinal stiffness assessment is a routine measurement adopted by manipulative practitioners .Notably, this assessment has face validity to evaluate changes of spinal biomechanics after manual therapy] and to guide treatment options based on spinal mobility.
To examine spinal stiffness, a clinician applies a manual PA force to the lumbar spine in general or to a spinal landmark (e.g. spinous process). The clinician then perceives the stiffness/movement of the spine. This may be repeated with adjacent segments to evaluate the relative stiffness of different spinal regions. »
A ce titre de nombreuses autres études auraient pu être citées, mais il ne figure pas de schéma d’étude plus pertinent que d’autres pour poser le cadre du sujet traité. De plus, les techniques analysées comme la PA (pression postéro-antérieur sur une vertèbre) sont bien décrites dans cet article.
L’étude dans une première partie fait le point sur la fiabilité et validité des PAIVM et conclue que ces derniers ne sont ni fiables ni valides, en accord avec les données fournies par notre article. A la suite de cela elle apporte de nombreuses solutions pour rendre plus crédible la littérature sur le sujet dont les auteurs trouvent la qualité méthodologique insuffisante.
L’étude de Wong aurait pu être citée sur les trois points de cette partie de du 1er article de la série tant elle résume l’ensemble de la littérature sur le sujet.
Pour ce qui est de son deuxième appel dans le texte du 1ere article de la série, son 2e objectif était la recherche de la relation entre mobilité et symptômes ce qui convient parfaitement à sa citation dans cette partie corps du texte.
Les auteurs segmentent leur article en plusieurs parties : ils cherchent d’abord à voir s’il y a une relation à un instant “t” via des études transversales et divisent en deux les données : une première partie où ils compilent les données de la littérature en faveur d’une association entre perte de mobilité et symptômes et une autre où ils compilent les données de la littérature en défaveur avec cette affirmation.
Dans un second temps, les auteurs répertorient des séries de cas, des études longitudinales et aussi des analyses secondaires d’ECR afin de déterminer s’il y a une corrélation ou un lien de causalité dans le temps entre perte/gain de mobilité et symptômes. Cette fois, on retrouve un argumentaire prônant l’idée qu’il y aurait un lien de causalité entre modification de la rigidité vertébrale et amélioration des symptômes. Ici, on retrouve des séries de cas citées, donc sans groupe contrôle. Le schéma des études ne permet d’exclure des facteurs confondants ni des biais de mesure. Il est étonnant aussi de voir que la direction de l’association n’est pas discutée, est-ce la diminution de symptôme qui pourrait faire augmenter la mobilité ou l’augmentation de la mobilité qui ferait diminuer les symptômes ?
Dans la réflexion de Wong et al portant sur le caractère prescriptif, de nombreuses études pertinentes montrant que les symptômes et la mobilité évoluent indépendamment du traitement effectué ne sont pas citées et ne permettent pas une discussion impartiale sur le sujet.
Dans une dernière partie, les auteurs répertorient les facteurs confondants qui pourraient influencer l’association mobilité/symptômes. Ils sont nombreux et rendent l’analyse de cette variable extrêmement délicate ; Nous rejoignons les auteurs sur ce point et c’est pour cela que l’étude a été citée à ce niveau là de l’exposé du texte. En effet, de nombreux facteurs pourraient être impliqués dans une association mobilité et symptômes, notamment autres que la biomécanique elle-même, si tenté que cette corrélation existe chez certains patients.
Bien que l’étude de Wong aurait en effet mérité davantage de développement et d’explicitation, le propos général de l’exposé reste cohérent.
« Les patients voient une diminution de leur douleur lombaire après une manipulation indépendamment du fait qu’il y ait une bonne ou mauvaise mobilité segmentaire au niveau lombaire (Wong 2017 ; Fritz 2005 ; Kulig 2004 ; Snodgrass 2012).”
La revue narrative de Wong confronte les différentes données sur le sujet et propose différents facteurs confondants qui pourraient influencer cette association mobilité-symptômes (Wong 2017). »
Etude rétrospective de Fritz (Fritz2005a) :
L’étude que nous citons ici n’est pas celle figurant dans les références, il y a eu une erreur de notre part. Étant donné qu’elle est citée par Mr Trudelle précédemment, nous la présentons succinctement (c’est aussi une erreur de sa part puisqu’il cite Fritz 2015, et que l’on retrouve cette étude de 2005 dans sa liste de référence).
Cette étude reprend les données des études de “Flynn” et de “Childs” (Flynn2002, Childs2003) et cherche à savoir si deux variables peuvent êtres prescriptives d’une manipulation lombaire : la durée des symptômes et la diffusion des symptômes. Les auteurs concluent que oui, cependant on ne retrouve pas de groupes contrôles. Ces variables sont des variables “normatives”, c’est-à-dire qu’elles évoluent avec l’évolution naturelle de la maladie, indépendamment de tout traitement effectué. Il aurait fallu un groupe contrôle pour conclure. Vous pouvez vous référer au deuxième article de notre série sur le sujet pour plus d’informations sur ce sujet (Série “Thérapie Manuelle vue par les preuves” : 2- Trouver de la certitude dans l’incertitude Henry2020).
Etude de Fritz correspondant à celle appelée dans le texte (Fritz2005b):
Voici l’étude que nous avons appelée dans le texte.
A première vue, citer cette étude paraît osé car les résultats ne semblent pas en accord avec nos propos. Expliquons notre choix en analysant ses données.
Cette étude a repris les résultats d’un ECR. Son objectif est de savoir si les patients qui présentaient une hypo mobilité étaient de meilleurs répondeurs à la manipulation vertébrale
Une mesure manuelle et trichotomique de la raideur vertébrale sur chaque étage de L1 à L5 a été effectuée.
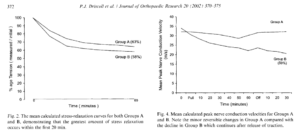
Voici les résultats présentés ici :
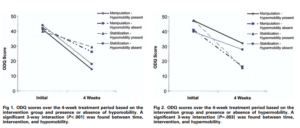
Les auteurs ont retrouvé que les patients présentant une hypo mobilité s’amélioraient mieux que ceux qui ne présentaient pas une hypo mobilité lors des manipulations vertébrales, ce qui n’est pas en accord avec la revue du même auteur en 2011 par exemple, qui conclue l’inverse (Fritz2011).
Pour expliquer cette différence, cette dernière souligne que les mesures manuelles de la rigidité vertébrale ne sont pas fiables et que c’est ce type de mesure qui a été réalisé dans l’étude de 2005.
De plus pour revenir à l’étude de 2005, le groupe exercice présentant une hypo mobilité s’est mieux amélioré que les autres, ce qui ne corrobore pas le modèle théorique.
Ce qui est aussi intéressant, et c’est pour cela que nous avons cité cette étude, tous les groupes se sont significativement améliorés et ce malgré le fait qu’ils présentent ou non une hypo ou une hyper mobilité.
Enfin, il n’est pas signalé si les physiothérapeutes étaient en aveugle ou non, ce qui pose un problème pour l’interprétation compte tenu de l’hypothèse de départ. Si les évaluateurs ont diagnostiqué une hypo mobilité et étaient ainsi convaincu que dans ce cadre-là la manipulation améliorerait les patients, cela pose un réel problème de biais dans les “résultats”. L’effet spécifique sur cette population type a clairement pu être surestimé
Cette étude par son analyse critique est donc en accord avec nos propos.
Etude de fritz2011: Cette étude est recitée par Mr Trudelle de la manière suivante : « L’étude de Fritz 2011 (17) citée le 13/04/20 montre des résultats sur les effets de la manipulation et l’absence de mobilité. Cela est discordant avec l’affirmation de l’auteur. C’est un biais de sélection. »
L’étude de fritz est très intéressante a bien des égards, ici les auteurs ont effectué 2 sessions de manipulation du bassin sur des patients lombalgiques. C’est une série de cas sans groupe comparateur avec un niveau de preuve faible.
Ils ont évalué instrumentalement la rigidité vertébrale de manière non spécifique (sur un étage en particulier L3 par rapport à L4) à chaque fois avant et après les deux sessions et sur une troisième sessions 3 jours après.
Les auteurs ont retrouvé qu’une moins grande rigidité vertébrale initiale était associé à de meilleurs critères de jugement fonctionnels 1 semaine après la première session, ce qui est en contradiction avec d’autres études comme celle discutée précédemment, et questionne sur la pertinence de ce critère et ce malgré la tentative d’analyse multivariée sur différent sous-groupe.
L’étude intègre deux nouvelles variables concernant la rigidité : la rigidité globale et la rigidité terminale ce qui complique encore un peu plus la compréhension du modèle d’hypo-hyper mobilité
Les auteurs ont retrouvé une réduction de la rigidité vertébrale associé à une amélioration des symptômes entre la première et la deuxième session, mais pas après, de plus les changements de raideur n’étaient pas maintenus dans le temps ce qui est en contradiction avec d’autres études là encore. L’absence de groupe contrôle rend très compliquée l’analyse des résultats et les conclusions que l’on peut en tirer. En effet, il est impossible de savoir si ces variations sont dues au hasard ou à des facteurs interférents non dues/liés spécifiquement à la manipulation ce qui a été émis comme hypothèses par d’autres études (Fereira2010)
Les auteurs retrouvent une réelle différence d’interprétation entre la rigidité locale et terminale et soulignent que l’évaluation manuelle par des opérateurs peut être biaisée et ne pas refléter la réelle rigidité vertébrale. Nous sommes tout à fait d’accord avec cette affirmation. Donc en pratique, en l’absence de mesure instrumentalisée, nous risquons avec une évaluation manuelle d’être fortement biaisés dans notre interprétation, quel est donc l’intérêt clinique de cette variable ?
L’étude de Fritz2011 ne contredit pas nos propos, cependant, compte tenu du caractère polémique des sujets présentés et ce afin d’éviter toute ambiguïté au détriment de la facilité de lecture, nous pourrions donc être plus précis pour être plus représentatifs de la littérature sur le sujet en rajoutant :
« Certaines études ont retrouvées des différences d’évolutions dans les critères de jugement selon que les patients présentent des vertèbres hypo-mobiles ou hyper-mobiles. Toutefois ces études ont un niveau de preuve faible et présentent de nombreux biais méthodologiques (Fritz2005b, Fritz2011)
De plus, elles présentent des résultats inverses, ainsi certaines concluent que les patients aux mobilités segmentaires diminuées s’amélioreront mieux suite à la mobilisation (Fritz2005b) alors que d’autres concluent le contraire (Fritz2011). Ces différences pourraient être dues au caractère instrumentalisé ou non de la mesure, la mesure instrumentale serait plus valide pour déterminer la mobilité segmentaire ce qui rend, si cela est le cas, son interprétation manuelle inutile et biaisée ».
Kulig2004 : Analyse en fin d’article de cette étude
Revue systématique de Snodgrass2012 :
Analysons l’étude que nous avons citées ici, cette revue tente de répondre à 4 questions :
- Comment la rigidité vertébrale est-elle mesurée, y compris les facteurs qui affectent sa mesure ?
- Comment la rigidité vertébrale est-elle utilisée dans le diagnostic ?
- Quelles est la place de la rigidité vertébrale dans le pronostic et le processus décisionnel ?
- Quelle est l’effet de la manipulation sur la rigidité vertébrale ?
- Réponse : Soit subjective par jugement du praticien soit instrumentale :
On retrouve 3 sous catégories pour l’instrumentale : soit raideur segmentaire, soit raideur physiologique de la colonne, soit mesure de la raideur en per-opératoire. Il semble que la fiabilité et la validité soient meilleures avec des mesures instrumentales, pour les mesures non instrumentales les facteurs pouvant interférer sur la perception de raideur ne sont pas contrôlés.
2. Réponse : Il n’y a pas suffisamment de preuves pour tirer des conclusions concernant l’utilité de l’évaluation de la rigidité pour identifier un niveau spinal/vertébral symptomatique ou déterminer le degré d’activation du muscle multifide chez les patients souffrant de lombalgie
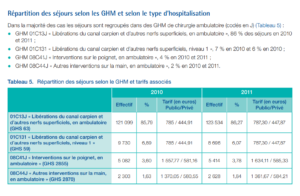
3. Réponse : Fritz et al. (2011) ont mesuré la raideur en utilisant des pressions postero-antérieures (PA) in vivo et ont rapporté qu’une diminution immédiate plus importante de la raideur après manipulation était faiblement associée à une amélioration plus importante du questionnaire sur le handicap Oswestry sur 6 à 8 jours. Cette étude (que nous avons analysée auparavant) a en outre identifiée que des valeurs de rigidité inférieures enregistrées au départ étaient liées à des degrés d’amélioration plus élevés au cours de la même période. Cependant, les deux facteurs ne représentaient qu’une petite fraction de la variabilité des résultats dans cette étude. Les études sur le pronostic suggèrent que la rigidité de la colonne vertébrale jugée par le praticien n’est pas un prédicteur efficace des résultats pour les patients, tel que mesuré par divers questionnaires de rapports de patients (tableau 5).
Citons : « Quant à savoir si la raideur vertébrale peut modérer ou médier les effets du traitement, il y a très peu de preuves. Deux études suggèrent que la rigidité rachidienne de base peut modérer les effets de la manipulation de la poussée (Childs et al., 2004; Fritz et al., 2005b), une raideur accrue entraînant une réponse plus favorable, mais la raideur ne semble pas modérer les effets de techniques sans poussée (Ferreira et al., 2009; Hancock et al., 2008) (tableau 6). En tant que médiateur des résultats du traitement, seules de faibles corrélations (r <0,6) ont été signalées entre la raideur vertébrale et divers résultats pour les patients (Ferreira et al., 2009; Fritz et al., 2011; Tuttle et al., 2008a) »(traduction personnelle).
4.Réponse : Citons : « Deux études ont conclu que les changements de rigidité n’étaient pas plus importants après l’application de techniques sans poussée par rapport à un contrôle au repos (Goodsell et al., 2000; Tuttle et al., 2008a) […] L’étude restante utilisant une mesure de rigidité instrumentée a rapporté que la rigidité a diminué immédiatement après l’application d’une technique de poussée, mais les changements de rigidité n’ont pas été maintenus plus de 3 à 4 jours. »

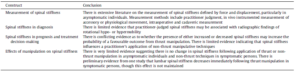
Tableau numéro 5 issu de l’étude Snodgrass2012
Cette étude est bien en accord avec nos propos, le niveau de preuve est ici élevé.
Les références suivantes sont appelées à la suite de cette phrase : « L’amélioration via l’application d’une technique manuelle n’est pas dépendante d’une approche biomécanique spécifique ».
Un grand nombre d’étude sont appelées pour justifier cette phrase, analysons les :
ECR de Chiradjenant2003 : Les groupes sont ici similaires à la “baseline” ( sauf pour la durée des symptômes) , les auteurs soulignent le manque d’homogénéité des participants , mais leurs caractéristiques restent représentatives de la pluralité des patients que nous pouvons rencontrer en pratique clinique. Contrairement à ce qu’affirme Mr Trudelle, nous ne voyons pas cela comme une limite, d’autant que les différences à la baseline ne sont pas statistiquement significatives.
L’amélioration plus importante résultante de la mobilisation des étages vertébraux bas résulte d’une analyse secondaire sans rapport avec la question de recherche initiale, elle n’a donc pas valeur de preuve mais questionne et encourage la mise en place d’un essai spécifique à cette question. Compte tenu du manque de cohérence externe et du caractère secondaire de cette information, celle-ci n’a donc pas été relayée.
Cette étude est en accord avec nos propos dans l’article de par son schéma et les résultats qu’elle propose : les mobilisations aléatoires étaient aussi efficaces que les mobilisations spécifiques découlant d’un raisonnement à caractère biomécanique ( recherche d’hypo mobilité segmentaire).
ECR d’Aspinall2019 : L’objectif de cet essai est d’évaluer l’effet neurophysiologique d’une manipulation lombaire, comparé à un placebo de manipulation. Apsinall décrit la différence entre ces deux interventions seulement par des modalités d’ordres biomécaniques : « The sham intervention involved similar positioning to the real SMT, but contacting over the upper medial gluteal musculature with a broad non-specific palm contact. The participant’s spine was kept relatively neutral with around 90° hip flexion, to minimise tension on the spine. A slow, gentle, non-specific ‘thrust’ was delivered into the gluteal musculature in conjunction with a small ‘body drop’ from the clinician. The sham was intended to mimic the active intervention in positioning and hands-on contact, and to give the participant the perception that ‘something happened’ »
Cette étude est en accord avec nos propos
ECR de Kanlayanaphotporn2009
C’est un ECR qui a comparé les effets de mobilisations prescrites aléatoirement vs celles découlant d’un raisonnement biomécanique spécifique.
Mr Trudelle affirme que dans cet ECR les thérapeutes ne prennent en compte que la douleur pour choisir la technique de mobilisation. Cette affirmation est fausse, les auteurs soulignent que les thérapeutes choisissent de manière pragmatique la technique à effectuer en fonction de la douleur et de l’hypo-mobilité vertébrale : « The level(s) that were found to be hypomobile or painful in the manner that matched the characteristics in which the patients were affected were deemed responsible for the patients’ symptoms »
Un autre thérapeute manuel a signalé que la prise en compte de la douleur dans le processus décisionnel ne permettait pas de conclure à la prise en compte seule de l’hypo mobilité, c’est vrai, mais est ce une situation qui peut être rencontrée en pratique clinique ? Les auteurs ont privilégié une approche pragmatique représentative de la pratique clinique, en incluant et l’appréciation de la mobilité segmentaire et l’appréciation de la douleur. On pourra toujours dire que l’appréciation de la douleur a pu fausser l’appréciation de la mobilité, c’est une hypothèse possible mais peu probable, les valeurs clinimétriques semblant plus intéressantes pour l’appréciation de la douleur segmentaire que de la mobilité. De plus, le fait d’objectiver une douleur spécifique d’un étage ne remet aucunement en question les propos que nous rapportons, une douleur en lien avec un segment donné renvoie sur le modèle théorique, à un modèle biomécanique plus que neuro physiologique et globalisé.
En conclusion de cette étude, la sélection de la technique manipulatoire en fonction de l’hypo-mobilité et de la douleur segmentaire rapportée par le patient n’a pas apporté de résultats supérieurs par rapport à une technique aléatoire
Cette étude est en accord avec nos propos
Pour ce qui est de la figure de cet article reportée par Mr Trudelle via la phrase suivante :
« Pourquoi la figure 2 de la P-190, de cet article qui aborde le gain de mouvement n’est pas retenue au titre de l’amélioration mécanique du mouvement ? Est-ce un biais de sélection ? Est-ce un biais d’interprétation ? Ce n’est pas évoqué. »
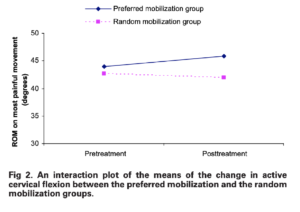
Voici la réponse à sa question : « For both groups, the most notable improvement in active cervical ROM after mobilization was on most painful movement (see table 3). These values were also found to be in the same ranges reported by previous studies.17,18 Because all of the changes were less than 3°, which were within the range of the measurement error of this study, this indicated that there were no apparent differences in cervical ROM between the preferred and the random mobilization techniques. These negligible changes in cervical ROM might reflect the trivial changes in the intervertebral segmental ROM during the oscillatory mobilization » (Kanlayanaphotporn2009)
(De nombreux ouvrages existent pour se familiariser à la lecture critique des données statistiques des études)
Ecr de Aquino2009 : Aquino compare dans son ECR une mobilisation cervicale (au choix dans celles décrites par maitland) sur l’étage symptomatique modulé en terme de grade en fonction du feedback du patient vs une mobilisation sur un étage aléatoire. Effectivement ici, il n’est pas explicité de recherche d’un étage hypo-mobile pour sélectionner la technique.
Les auteurs n’ont pas retrouvé de différence entre une approche sur un étage aléatoire et une approche sur un étage symptomatique.
Toutefois, il remet en question par ces résultats les différentes hypothèses biomécaniques comme le cite “de oliveira”
« Many manual therapists, osteopaths, and chiropractors are still heavily oriented by a biomechanical mechanism where mechanical forces applied to specific vertebral regions may alter segmental biomechanics by releasing trapped meniscoid lesions, releasing adhesions, or reducing distortions of the annulus fibrosus.13 This biomechanical mechanism of action would allow the vertebral segments to move in a greater range of motion and would reduce the mechanical stress on paraspinal muscles, thus reducing pain and discomfort. However, the mechanisms underlying the effects of SMT seem much more complex than a simple biomechanical oriented model and are more likely to be better explained by a combination of biomechanical and non biomechanical effects »
(De Oliverira2013)
Bien que cet ECR remette en question l’intérêt d’une mobilisation spécifique et explique son appel dans notre article, nous pensons qu’il est pertinent compte tenu du caractère polémique de cette phrase de la détailler, nous y reviendrons à la fin de l’analyse des 8 articles appelés ici.
Cette étude est en accord avec nos propos
ECR de Oliveraira2013 : L’objectif de cet ECR est : « The results from our study could lead to a better understanding of nonbiomechanical effects of this popular intervention in patients with chronic low back pain ».
L’objectif numéro 1 est de comparer une mobilisation lombaire spécifique sur des patients lombalgiques chroniques vs une mobilisation thoracique non spécifique.
L’étage vertébral à manipuler est confirmé par des éléments d’ordre biomécanique « The diagnostic palpation test in the transverse plane, also known as the Mitchell test, was used to verify vertebral positioning and mobility »
L’étude ne retrouve pas de différence entre les deux groupes.
Cette étude est en accord avec nos propos.
ECR de Schomacher2009 : Cet ECR est réalisé sur des patients cervicalgiques. On réalise ici une mobilisation cervicale selon l’étage symptomatique (plusieurs tests visant à cibler l’étage ont été effectués, on ne se limite pas qu’à la douleur rapportée), ou selon une mobilisation aléatoire.
Aucune différence n’a été retrouvée entre les deux groupes. Les examinateurs de plus n’étaient pas en aveugle sur l’allocation et sur la collecte des résultats, les patients étaient en aveugle.
L’intérêt biomécanique est là encore discuté, les auteurs ne rejettent pas l’hypothèse que les mobilisations étant non spécifiques, il pourrait y avoir un effet biomécanique sur plusieurs étages en plus des effets neurophysiologiques et sympathiques que l’on retrouve fréquemment décrits.
L’approche biomécanique spécifique par les résultats apportés peut ici être remise aussi en question.
L’étude est en accord avec nos propos.
ECR de Mc carty2019 :
C’est le dernier essai paru sur ce sujet à notre connaissance. Cet ECR qui compare manipulation régionale vs manipulation lombaire spécifique sur des patients lombalgiques, mesure la douleur et l’activité musculaire à l’EMG (multifides et iliocostal).
L’identification de l’étage spécifique à manipuler se fait comme suit :
« The joint targeted for manipulative thrust was the spinal location deemed to be most symptomatic during the clinical examination, using active movement observation, passive movement assessment of resistance to movement and pain provocation tests ».
La prise en compte d’une hypo-mobilité afin de sélectionner l’étage à manipuler est donc présente.
On ne retrouve pas de différence retrouvée sur la douleur entre les deux techniques (régionale ou spécifique). On note des changements sur l’activité EMG mais les auteurs soulignent que ceux-ci pourraient être liés à des facteurs interférents
On retrouve des biais dans l’étude avec un risque beta important.
Cette étude est en accord avec nos propos.
ECR de donaldson2016 :
Donaldson et al a investigué sur le moyen et long terme la différence entre mobilisation prescrite et mobilisation spécifique sur des patients lombalgiques.
On prescrit à un groupe des PA- L4 et L5 2×60 secondes chacun avec 30 secondes de pause sur 4 séances.
L’autre groupe reçoit les mêmes mobilisations sur l’étage symptomatique, les modalités sont effectuées en fonction du feedback du patient, et on ne se base que sur la douleur rapportée par le patient.
On ne retrouve pas de différence entre les groupes.
Cette étude est bien en accord avec nos propos.
Pour conclure, toutes les études citées à la suite de la phrase suivante « L’amélioration via l’application d’une technique manuelle n’est pas dépendante d’une approche biomécanique spécifique » sont pertinentes et en accord avec nos propos.
En effet, l’amélioration se produit quelque soit la technique employée et ce même si celle-ci est réalisée aléatoirement, qu’importe le raisonnement, qu’il soit biomécanique ou neurophysiologique.
On pourrait afin d’éviter toute polémique préciser nos propos découlants de cette phrase :
« L’amélioration via l’application d’une technique manuelle n’est pas dépendante d’une approche biomécanique spécifique, en effet les patients vont s’améliorer de la même manière suite à des manipulations ou des mobilisations découlant d’un processus décisionnel en lien avec l’évaluation d’hypo-mobilité ou d’hypermobilité (Deoliveira2013, Chiradjenant2003), de la douleur rapportée à la pression localisée ( Donaldson2016, Schomacher2009) ou de processus mixant ces notions (McCarty2019, Aspinall2019, Kanlayanaphotporn2009). Compte tenu du niveau de preuve des études, de la qualité de ces dernières, de leur validité et cohérence externe, il n’existe aucune contestation possible au fait que l’amélioration est indépendante d’un choix de manipulation ou mobilisation spécifique sur un étage donné pour un grand nombre de population ».
Etude diagnostic de Abbott2005:
Cette étude est citée de la manière suivante par Mr Trudelle “Les stratégies des physiothérapeutes sont le plus souvent simples sur ce sujet : si un patient présente des zones hypomobiles et des zones hypermobiles sur le rachis. Il peut présenter des douleurs car il sursollicite les zones hypermobiles et le thérapeute va proposer de mieux répartir le mouvement en améliorant la mobilité segmentaire des zones hypomobiles distantes. L’objectif étant de « décharger » les zones sur-sollicitées. Les mobilisations sur des étages distants de la zone douloureuse sont plus adaptées… Nous avons déjà cité Fritz (5) sur ce sujet. Il y a des études plus techniques comme celle d’Abbot (28). »
Cet appel de référence est inadapté. C’est une étude diagnostic cherchant à évaluer des tests de mobilités PAIVMs et PPIVMs ( flexion et extension) afin de diagnostiquer une instabilité vertébrale régionale. Le mot “régionale” est important.
Les auteurs soulignent en effet qu’il ne serait pas pertinent de chercher à diagnostiquer à l’échelle d’un seul segment vertébral, ce qui rejoint les propos rapportés dans le premier article, donc on parlera d’instabilité lombaire supérieure et inférieure:
“This was decided a priori, and considered necessary because there is considerable evidence that therapists are not sufficiently accurate in identifying specific segmental levels by palpation, although they are usually within one level (up or down) and are generally reliable at locating again a segment they had previously located [11–13]. This inaccuracy presented an unacceptable risk of misclassification, that collapsing into regions would attenuate. Furthermore, it is also clear that some physical assessment procedures affect mobility at multiple segments [14] and that segmental specificity does not appear to be important with regard to application of physical therapies for LSI, including manual therapy [5,15–22] (although one study has found otherwise [23]). Data were thus collapsed into the 2 × 2 tables. By-segment results are, however, provided [see Additional file 1] for readers to compare.”
Le terme d’instabilité lombaire pose aussi question, en effet celui-ci est déterminé en référence standard par une comparaison avec une moyenne sur une population de personnes asymptomatiques, toutefois nous ne retrouvons aucune donnée sur cela dans l’étude et les annexes associées.
Nous pouvons aussi nous questionner sur sa pertinence tant la prévalence retrouvée d’instabilité lombaire dans l’échantillon symptomatiques est faible:
“Sagittal rotation LSI was not found in statistically significant numbers (6 of 468 segments, or 1.3%), which is smaller than the number that would be expected by chance alone in a normally distributed sample of this size. Sagittal translation LSI was found at a prevalence of 3.6% (17 of 468 segments) (χ2 p < 0.05). In this cohort, 5.6% of individuals had rotation LSI at least one segment, and 12.0% had translation LSI at least one segment
Finalement, l’étude n’a rien à voir avec son appel de référence, elle ne permet pas de justifier les propos de Mr Trudelle, de plus les éléments rapportés par les auteurs sont en accord avec les données de la littérature citées dans mon premier article.
- Fiabilité et validité palpatoire
Etude de Cooperstein2016 : Cette revue systématique réalisée par un chiropracteur évalue la fiabilité palpatoire des EIPS : « Reliability could pertain to assessing the location of a single PSIS, or to assessing the bilateral symmetry of the PSISs on the superior-inferior axis (i.e., assessing whether one PSIS was caudal to the other) »
Donc la fiabilité palpatoire d’une ou de deux EIPS l’une par rapport à l’autre. Les auteurs soulignent bien ici, que la palpation des EIS est une condition nécessaire à la bonne réalisation de certains tests orthopédiques : « Since palpation of the PSISs is the starting point for other pelvic examination procedures, examiner inability to agree on the location of the PSIS may negatively impact their ability to perform, interpret, and agree upon the results of other manual pelvic examination procedures »
Mr Trudelle dit « Cette revue systématique de chiropraticien étudie des tests relatifs à des tests de mobilité ou de positionnement des os du bassin » . Cette affirmation est erronée.
Les informations apportées par l’étude et décrites dans l’article sont donc maintenues et réaffirmées, la fiabilité palpatoire des EIPS inter examinateur a un coefficient kappa de O,27 donc faible. Nous précisons qu’en intra examinateur le coefficient kappa de l’ensemble des études n’est pas rapporté, les résultats semblent meilleurs mais insuffisants pour considérer que cette dernière est fiable.
L’étude est en accord avec nos propos.
Nous ne comprenons pas dans ce cadre les références citées par Mr Trudelle, et la phrase suivante : « L’auteur a publié d’autres études avec des résultats positifs sur une revue systématique en 2017 (30) ou des études spécifiques en 2018 (31) »
Etude de Cooperstein2018 :
L’étude de 2018 de Cooperstein, porte sur le test de Gilet ce qui est un hors sujet, puisque rendre dans le cadre de la perception de mobilité et non dans la palpation pure et que la perception de mobilité de la sacro iliaque n’est qu’une illusion compte tenu des très faibles mobilités qui y sont associées. De plus les résultats ne sont pas « positifs » puisqu’ils remettent en question la validité du test de Gillet en tant que test de mobilité sacro-iliaque :
« This study questions the validity of the upright Gillet test for sacroiliac motion. »
L’article cité dans la relecture de Mr Trudelle n’est pas pertinent et les propos rapportés par Mr Trudelle sont faux.
Etude de Cooperstein2017 :
L’étude de 2017 est justement citée dans notre l’article pour critiquer la règle portant sur « la ligne des crêtes iliaques, censée être en regard de l’espace intervertébral L4-L5 ». Pourquoi dans ce cas Mr Trudelle nous demande de la citer ?
Mr Trudelle cite ensuite la revue systématique de Huijbregts pour nourrir son argumentaire avec la phrase suivante « La revue systématique couvrant différentes régions à palper donne des résultats tout opposés ».
Regardons ce qu’il en est et voyons si les résultats si les résultats sont tant que ça en désaccord avec nos propos :
Etude de Huijbregts2002 :
Cette revue de 18ans englobe de nombreuses données, elle étend la question de recherche à la palpation statique de zone osseuse, mais aussi musculaire, ou encore sur la perception de mobilités à la fois sur les étages thoraciques, cervicaux et lombaires, dans quel cadre Mr Trudelle porte donc cette affirmation ? C’est difficile de répondre.
Vous pouvez voir ci-dessous un des nombreux tableaux de l’article, il y figure de nombreux coefficient kappa n’excédant pas les 0,30. Les auteurs concluent d’ailleurs :
« Interrater agreement only rarely exceeds poor to fair agreement. »
Pour ce qui est de la fiabilité intra examinateur, celle-ci est meilleure mais peine sur bien des études à atteindre le niveau modéré de 0,4.
Ceci est donc en accord avec les propos rapportés dans notre article.
L’étude citée par Mr Trudelle est pertinente, mais les conclusions qu’il en tire sont fausses et non représentatives de l’étude. Au contraire celles-ci tendent à confirmer les propos rapportés dans notre article
Nous aimerions aussi comprendre ce qu’entend Mr Trudelle par biais d’interprétation, la revue de Cooperstein de 2017 nourrit correctement notre propos et est citée à juste titre
Les articles de Cooperstein 2017 et 2015 référencés sont bien appelés dans le texte contrairement aux propos rapportés par Mr Trudelle.
De nombreuses études de l’articles n’ont pas été commentées par Mr Trudelle aux titres que ce sont des thérapeutes d’autres professions, nous ne reviendrons pas sur ce débat mais il est vraiment regrettable et irrespectueux de stigmatiser et de ne pas prendre en compte le travail d’autres confrères qui sont avant tout des chercheurs.et qui œuvrent pour le bien des patients et de la recherche scientifique sur des sujets transversaux aux différentes professions.
Ainsi pour l’étude de Kim par exemple que nous avons citée, il faut savoir que celle-ci ne porte même pas sur la palpation mais sur la concordance radiologique de la ligne EIPS vis-à-vis d’un étage vertébral particulier afin de confirmer ou d’infirmer la règle palpatoire « EIPS en regard de S2 », un médecin est donc la personne la mieux indiquée pour interpréter une radiographie et monter ce type de protocole.
Etude de Merz2013 : C’est une étude diagnostic portant sur la validité palpatoire de L5. Les auteurs ont dans un premier temps cherché à connaître la précision palpatoire de 4 techniques différentes. Les chiffres donnés dans l’article portent sur ces 4 différentes techniques : « celle de L5 varie de 45 à 61 % selon la technique utilisée (Merz 2013) »
A titre informatif les techniques utilisés étaient le repère :
- Via la ligne des EIPS
- Via la ligne des crètes iliaques
- Via la palpation avec lordose délordose en position assise (on demande au patient de réaliser un mouvement de lordose délordose
- Via une dernière technique identique à la précédente mais en ayant marqué au préalable divers repère osseux.
Dans un second temps l’objectif était de voir si le fait de combiner ces techniques pouvait augmenter la précision palpatoire. En effet comme l’a signalé Mr Trudelle nous n’avons pas fait la mention que le fait de combiner les techniques augmentait la précision jusqu’à 83% pour trois techniques combinées, cela aurait pu être précisé dans notre article.
Nous suggérons donc la précision suivante : « celle de L5 varie de 45 à 61 % selon la technique utilisée mais peut augmenter jusqu’à 83% lorsque l’on combine différentes techniques »
C’est une information positive, on pourrait aussi rajouter qu’ici les auteurs ne se sont pas basés sur les particularités anatomiques des processus épineux, comme le suggère Philipps2009 ce qui pourrait encore augmenter la précision diagnostique.
Cette étude est en accord avec nos propos mais aurait mérité plus de précision dans le corps du texte de notre article.
En revanche nous ne comprenons pas la référence de Mr Trudelle à l’étude de Robinson, a-t ’il lu l’étude ? ou ne serait-ce même le résumé ou s’est il contenté de reciter l’étude citée par Merz et cal dans leur étude ? Analysons cette étude.
Etude de Robinson2009
Dès l’abstract on note que l’étude de Robinson s’est penché sur la fiabilité et la validité d’une seule technique palpatoire pour repérer C7 et L5. Si on rentre dans le détail, la technique pour C7 était l’extension assistée par le thérapeute, C6 devant s’antérioriser et « fuir sous les doigts » plus vite que C7. Pour L5 c’était la ligne des crètes iliaques qui était utilisée en repérage.
A noter que l’étude retrouve ici un accord inter évaluateur de 37% sur les marqueurs cutanés, ce qui est faible, la fiabilité intra évaluateur n’a pas été testée. La validité est faible voire très faible pour C7 et L5 avec un kappa respectivement de 0,18 et de 0,48. A noter que l’outil statistique utilisé ici est étonnant, puisque déterminé par un coefficient kappa.
Nous ne comprenons pas dans ce cadre la phrase de Mr Trudelle et la pertinence de cette référence « C’est aussi proposé dans l’étude de Robinson (37) qui propose d’assembler plusieurs tests pour assurer la reproductibilité »
Robinson fait juste référence à cela dans sa conclusion comme une piste éventuelle d’amélioration. Cela n’est pas du tout étudié dans l’étude en question, ni même plus approfondi que cela puisque non discuté dans la partie discussion si ce n’est par la phrase suivante :
« A combination of other palpation techniques, including counting the cervical SPs from occiput to C7, might have improved the results »
L’étude citée par Mr Trudelle n’est pas une preuve confirmant ses propos, sa référence n’est pas justifiée. De plus, les résultats retrouvés sont en accord avec nos propos.
- Fiabilité diagnostique de mobilité
Etude de Seffinger2004 :
Avant-propos sur cette étude : Mr Trudelle dans cette revue systématique ne rapporte que les résultats des études faites par des physiothérapeutes, résultats qui sont d’ailleurs en accord avec ce que nous rapportons dans notre article, à savoir que la fiabilité est faible. Ce fait de ne sélectionner qu’une poignée de résultats sur un critère donné s’appelle une analyse de sensibilité et permet, si cette donnée sélectionnée reste en accord avec le résultat global d’augmenter la robustesse des résultats de cette étude, nous remercions donc Mr Trudelle de nous permettre de renforcer notre argumentaire.
Les objectifs de l’étude sont les suivants « The authors performed a systematic review of original research articles, from all disciplines, published in peer reviewed journals in order to assess the quality of the literature and answer the clinical question : “What is the intra- and inter examiner reliability of spinal palpatory diagnostic procedures ?” »
Le but est d’analyser la fiabilité et validité de tests palpatoires de mobilité sur le rachis, qu’importe la profession, pourquoi à tout prix vouloir créer des “chapelles sectaires” ?
Le fait que des études de différentes professions répondent aux critères d’inclusions montre bien la similitude et la transversalité de nos pratiques avec d’autres professions.
Les auteurs concluent donc à une faible fiabilité de ces tests. La fiabilité intra examinateur reste meilleure qu’inter examinateur. Le niveau d’expérience ne jouait pas sur les résultats, le fait que les sujets soient symptomatiques ou pas non plus. Les tests régionaux ont de meilleures propriétés clinimétriques que les tests segmentaires. Les auteurs soulignent aussi que les tests de provocation de douleur restent plus fiables que les tests de mobilité. Il est à noter que l’on manque d’informations et de précision sur les tests effectués dans les études analysées. Comme toutes les études de fiabilité, les auteurs soulignent une hétérogénéité dans l’application des tests, dans le design de l’étude et dans les outils statistiques utilisés, ce qui compromet l’interprétation générale des résultats.
Cette étude est en accord avec nos propos, et ce malgré une analyse de sensibilité effectuée vis-à-vis de la profession.
Etude de Stochkendahl2006 :
Nous citons cette étude dans le cadre suivant : « Fiabilité inter-examinateur: accord très faible k<0,17 (Seffinger 2004 ; Stochkendahl 2006) / Fiabilité intra-examinateur: accord faible k< 0,35 (Seffinger 2004 ; Stochkendahl 2006) »
Cette revue systématique a été publiée en 2006. Les auteurs partent du principe qu’il existe de nombreux biais dans les revues de littérature déjà existantes, et qu’un nouveau travail de ce type est nécessaire. Les auteurs ont pour objectif de réaliser une méta analyse afin de déterminer si les techniques de palpation de mobilité sont fiables ou non.
Les termes sont bien décrits et définis. Les critères d’inclusion et d’exclusion bien explicités. Les auteurs ont élaboré en accord avec les directives existantes sur le sujet leur propre échelle de qualité méthodologique des études inclues. La lecture des articles a été réalisée indépendamment par deux auteurs et un troisième devait trancher en cas de désaccord ensuite. On reprochera un manque d’informations sur la méthode avec l’absence d’équations de recherche explicites. La démarche pour l’élaboration de la méta analyse semble ne pas présenter de biais et est décrite exhaustivement.
Une analyse de sensibilité a aussi été effectuée pour renforcer les résultats. On retrouve ici 63 % des études inclues de haute qualité ce qui est une bonne surprise quand l’on voit que de nombreux auteurs ne concluent pas, à cause du fait que les études incluent soit de mauvaise qualité. Toutefois cette donnée est à prendre avec précautions puisque découlant d’une évaluation de la qualité méthodologique non consensuelle.
Voici l’« analyse de Mr Trudelle sur cette étude : « Nous ne commenterons pas le travail d’une autre profession. Ce que dit le résumé : « There was strong evidence that the interobserver reproducibility of osseous and soft tissue pain is clinically acceptable (𝛋≥0.4) and that intra observer reproducibility of soft tissue pain and global assessment are clinically acceptable” ».
Il aurait été interessant de réaliser une lecture plus approfondie : « Strong evidence for clinically unacceptable levels of reproducibility for intra- and interobserver MP and STC was found. » MP étant la palpation avec mobilité ce qui est précisément le sujet discuté dans cette partie de notre article.
Il aurait pu aussi, s’il avait pris la peine de lire l’article, analyser les forest plot et voir que les intervalles de confiances se chevauchent que ce soit en inter examinateur mais aussi en intra examinateur. Et que les auteurs par leur phrase dans le résumé cité par Mr trudelle « There was strong evidence that the interobserver reproducibility of osseous and soft tissue pain is clinically acceptable (𝛋≥0.4) and that intraobserver reproducibility of soft tissue pain and global assessment are clinically acceptable » semblent conclure de manière trop optimiste au vu de leurs données statistiques.
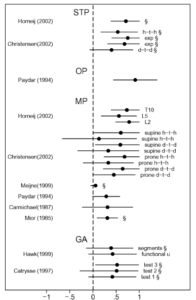

On retrouve encore une fois les mêmes informations que dans d’autres revues, ce qui renforce la cohérence externe : « The reproducibility of palpation for pain response is consistently higher than palpation for motion and, consistently, substantially higher within an observer than among different observers » mais les auteurs soulignent que pour ces deux conditions les résultats pourraient être surestimés « However, both palpatory pain studies and intraobserver studies in general have inherent problems with blinding of observers. In intraobserver studies, conscious and unconscious cues may render blinding of the observers impossible, and the independence of measures can not be guaranteed. In palpatory pain studies, blinding of subjects is impossible. Both situations imply the risk of overestimating reproducibility »
Pour finalement conclure « The reproducibility of MP, STC, and SP is not clinically acceptable. The level of evidence is strong for interobserver reproducibility of MP and STC, whereas no evidence or conflicting evidence exists for SP and intraobserver reproducibility of STC. »
Cette étude est en accord avec nos propos dans l’article et les renforce avec des preuves de fortes évidences, la palpation d’un étage vertébral hypo-mobile ou non n’est pas fiable
Etude de Haneline2009 :
L’étude de Haneline est une revue de littérature présentant la méthodologie d’une revue systématique, les auteurs ne pouvant garantir que l’analyse fut réellement systématique cette dernière n’est pas déclarée comme telle. Les critères d’inclusion sont : des études s’intéressant à la fiabilité palpatoire de la région lombaire et sacro iliaque et la fiabilité palpatoire de points douloureux, de repère osseux. Les auteurs soulignent que les techniques qui se sont basées sur la plainte douloureuse du patient étaient plus fiables, ce qui est en accord avec de nombreuses autres études. Cependant la différence ici est non statistiquement significative avec les autres techniques.
Cet article aurait dû être cité sur le paragraphe précédent car ici n’était pas analysé la fiabilité dans la recherche d’hypo mobilité.
C’est une erreur de citation de notre part.
Etude de Bracht2015 :
Nous citons cette étude dans le cadre suivant : « La fiabilité diminue encore pour l’évaluation de la mobilité en rotation segmentaire (Bracht 2015)
L’étude de Bracht qui est un physiothérapeute australien cite les lois de Fryettes et les dysfonctions articulaires comme référence sur les bases du modèle biomécanique en thérapie manuelle. Cette étude est une étude diagnostique qui a pour objectif d’évaluer la fiabilité intra examinateur et inter examinateur en rotation lombaire. L’étude à été réalisée sur des sujets sains ce qui ne semble pas cette fois-ci poser de problèmes à Mr Trudelle, est-ce un biais d’interprétation ? De notre côté, cela ne pose pas de problème, car nous nous basons sur les résultats de Stockendhal et al qui ont montré que les résultats ne différaient pas entre personnes symptomatiques et asymptomatiques, et que ceux-ci étaient lorsqu’ils étaient mélangés dans l’inclusion plus représentatifs d’une pratique clinique réelle.
« In a clinical situation, a mix of both asymptomatic and symptomatic patients will most likely present to practitioners of manual medicine. Therefore, the study population should consist of a mix of both symptomatic and asymptomatic subjects so that the reproducibility of the testing procedure has a relation to the characteristics of the study population. Finally, in spite of the use in every day clinical routines, test procedures do not always necessarily evaluate the clinical entity it is intended to evaluate, and it is therefore important to discuss the content of the test procedure » (Stockendhal2006)
L’étude de Johnson2018 que nous allons analyser ensuite rapporte d’ailleurs que le fait de n’avoir inclu que des personnes symptomatiques dans son analyse réduisait sa validité externe et était une limite à son étude.
Dans l’étude de Bracht, les observateurs ont classé la position de la vertèbre comme neutre, en rotation vers la droite et en rotation vers la gauche. Ils ne savaient pas quel participant était évalué et ne connaissaient pas les résultats antérieurs. La fiabilité était faible en intra et en inter examinateur. Le test a été réalisé en position du patient allongée sur le ventre. Les patients ne pouvaient pas interagir avec l’évaluateur. Les valeurs de k et kp ont varié de 0,07 (IC a` 95% de 0,10 a` 0,245) a` 0,37 (IC a` 95% de 0,11 a` 0,63) dans le cas de la convergence intra-observateur et de 0,12 (IC a` 95% de 0,06 a` 0,29) a` 0,30 (IC a` 95% de 0,08 a` 0,52) dans celui de la convergence inter observateur.
Les auteurs mettent en biais potentiel leur classification qui pourrait expliquer ce résultat.
Cette étude est en accord avec nos propos.
Etude de Johnson2018 :
Mr Trudelle cite cette revue de la manière suivante : « Pourquoi la revue systématique du physiothérapeute Johnson (42) sur la cervicalgie et la valeur diagnostique n’est pas retenue ? Pourquoi le tableau 3 n’est pas mis en avant, alors qu’il montre l’étendue de la concordance de l’examen dans beaucoup de secteurs ? Il y a des couleurs pour aider le lecteur à s’y retrouver ».
Avant d’analyser l’étude nous allons répondre à ces questions.
Cette étude n’a pas été citée car elle n’a pas été identifiée dans la recherche découlant de l’article ce qui est bien dommage car celle- ci est très pertinente pour être référencé dans notre article.
Maintenant lorsque nous analysons l’article en lui-même il est intéressant de constater que celui-ci reste en accord avec nos propos :
« The results showed differing reliabilities for the included tests ranging from poor to almost perfect. In conclusion, active movement and pain for pain or mobility overall presented acceptable to very good reliability (Kappa >0.40); while passive intervertebral tests had lower Kappa values, suggesting poor reliability. » Encore une fois les tests cherchant à reproduire la douleur sont plus fiables que les tests se basant sur une évaluation de la mobilité segmentaire. La fiabilité de ces derniers étant rapportée comme faible.
Une autre phrase dans l’abstract a éveillé notre attention, les auteurs signalent que la fiabilité augmente avec la qualité des études, ce qui est concordant avec les résultats rapportés par d’autres revues systématiques sur le sujet (Stockhendhal2006).
Le tableau 3 avec de jolies couleurs est le suivant :
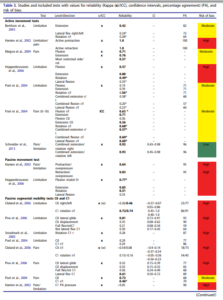
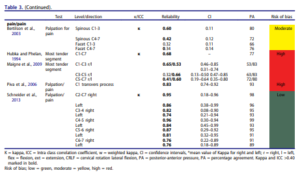
Ce tableau rapporte les coefficients kappa inter évaluateur, seulement deux études inclues ont réalisé une mesure intra évaluateur. Il est très intéressant :
Premier constat, les études portant sur la perception de mobilité sont celles avec la plus faible fiabilité. Les auteurs mettent en avant le fait que les études avec un faible risque de biais rapportent une meilleure fiabilité, mais ce constat ne semble pas généralisable puisque seule l’étude de Sneider2013 tend vers cette tendance, elle est la seule avec un faible risque de biais. Les auteurs ne devraient pas pouvoir généraliser en ne se basant que sur une seule étude. L’étude de Sneider est d’ailleurs celle citée ensuite par Mr Trudelle, Nous reviendrons plus tard spécifiquement sur cette étude qui semble d’ailleurs ne pas se baser que sur la perception de mobilité mais aussi sur la reproduction ou non de douleur. Si l’on se penche sur les intervalles de confiance (figure ci-dessous) on constate que la fiabilité pourrait ne pas être si satisfaisante que cela dans l’étude de Schneider.

Cette étude citée par Mr Trudelle est pertinente, elle renforce nos propos tenus dans l’article.
Etude de Walker :
Etude transversale pour déterminer la fiabilité des techniques de palpation de mobilité en thoracique.
Etude réalisé par des physiothérapeutes australiens. On retrouve ici deux chiropracteurs qui ont déterminé des étages thoraciques hypo mobiles ou non par l’intermédiaire de leurs propres techniques et de techniques standardisées révisées au préalable.
Les auteurs ont retrouvé une fiabilité inter examinateur faible, comprise entre k =[-0,27-0,36]. Ici la recherche d’étages plus douloureux que d’autres n’a pas montré de meilleurs résultats k=[-0,38-0,32]. Cela pourrait peut-être être dû à l’échantillonnage varié d’individu, avec des personnes inclues symptomatiques en thoracique ou l’ayant été.
Les valeurs clinimétriques étaient souvent pires lorsque l’approche était non standardisée.
Les résultats sont cohérents avec d’autres études comme celle de Christensen.
L’étude est en accord avec nos propos. Aucune RS a été effectuée spécifiquement sur la zone thoracique.
Nous avons cité cette étude avec la phrase suivante : « Ces conclusions peuvent être généralisées aux autres étages vertébraux ». Au regard des études inclues dans les revues systématiques précédentes qui portaient en grande majorité sur l’évaluation de segments lombaires ou cervicaux, il nous paraissait pertinent de rajouter une référence récente sur les étages thoraciques.
Il est vrai qu’il aurait été plus exact de reciter les études déjà citées et d’ajouter celle de Walker pour accompagner cette phrase.
A la suite de cela nous avons illustré un tableau de synthèse de Joshua Lavallée, Mr Trudelle affirme que les tests incluent ne sont pas pertinents et ne sont pas des tests de kinésithérapeutes, encore une fois Mr Trudelle affirme mais n’apporte pas d’élément justifiant son propos. Ces tests sont pour beaucoup encore enseignés en IFMK et font l’objet d’études par des physio-kinésithérapeutes.
Etude de Moriguchi2009 :
Cette étude proposée par Mr Trudelle porte exclusivement sur des sujets asymptomatiques, est ce un biais de sélection lorsque à l’inverse Mr Trudelle critique nos choix de références portant sur des sujets asymptomatiques ?
Cette étude porte sur la palpation de repères osseux en statique et n’est pas en accord avec le thème traité dans ce chapitre. Les auteurs concluent que la fiabilité est meilleure en intra évaluateur qu’en inter évaluateur ce qui est cohérent avec toutes les études citées précédemment et que celles-ci présentent des valeurs clinimétriques plus faibles lorsque les sujets sont en surpoids. Les auteurs concluent que la fiabilité est faible.
L’étude n’apporte pas vraiment de nouvelles informations pertinentes et présente peu d’intérêt.
L’étude citée par Mr Trudelle n’est pas pertinente et les résultats restent en accord avec nos propos rapportés dans la partie dédiée (2. Validité et fiabilité palpatoire.)
D’autres études sont proposées par Mr Trudelle, celui-ci cite une nouvelle fois Gwen Jull sans référence nous ne pourrons donc confirmer ou infirmer cette référence, l’étude de Schneider discutée précédemment est ensuite citée, celle-ci présente d’excellentes valeurs clinimétriques, analysons la.
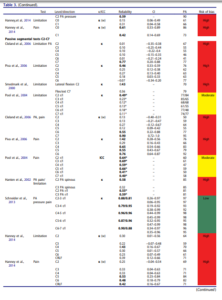
Schneider2013 :
Cette étude porte sur la fiabilité de 4 tests chez des patients référés pour un bloc facettaire cervical. Deux physiothérapeutes ont réalisé les tests suivants :
- Mesure des amplitudes actives des mouvements analytiques
- Test d’extension rotation et la recherche d’une reproduction de symptôme
- Palpation musculaire douloureuse (muscles segmentaires profonds)
- Palpation d’une hypo-hypermobilité au niveau segmentaire des PAP mais la reproduction de douleur était aussi recherchée
Comme dit précédemment cette étude présente des résultats très éloquents et intrigue car les résultats qu’elle présente sont à l’opposé des résultats de l’ensemble de la littérature sur le sujet
Les voici synthétisés dans le tableau ci-dessous :
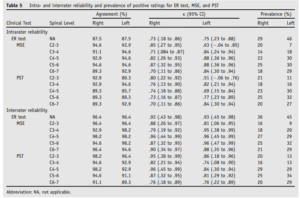
On peut constater que les coefficients kappa sont meilleurs en inter évaluateur qu’en intra évaluateur, ce résultat peut paraitre étonnant mais pourrait être expliqué par l’évolution naturelle de la maladie car la seconde mesure a été réalisée 7 jours après
Les résultats pourraient être meilleurs que sur d’autres études du au fait que
- Les évaluateurs se basaient et sur la perception de mobilité et sur la douleur ce qui est cohérent avec d’autres études sur le sujet
- La population testée est non représentative d’une population rencontrée en clinique, elle est homogène et fortement symptomatique, elle répond positivement à des tests diagnostiques et prescriptifs spécifiques. Cela influe sur la pertinence clinique de l’étude mais peut aussi faire gonfler l’accord artificiellement et que celui-ci soit du au hasard
- Les évaluateurs effectuaient 4 tests, les résultats des différents tests pourraient biaiser le jugement des évaluateurs sur les tests suivants, or c’est ici des valeurs pour des tests réalisés individuellement qui sont rapportées ici.
Enfin on retiendra que les intervalles de confiance sont extrêmement larges et chevauchent des valeurs kappa faibles.
Cette étude, bien qu’intéressante et de bonne qualité méthodologique, présente donc des limites et ne remet donc pas en question toutes les données existantes sur le sujet qui apportent des conclusions différentes
Cette étude est pertinente, celle-ci est unique du fait de ses conclusions à l’opposé de la littérature sur le sujet, elle pourrait amener de nouvelles pistes de recherche intéressantes. Toutefois compte tenu des points soulevés précédemment et du manque de cohérence externe, cette dernière ne remet pas en question nos propos.
- Validité diagnostique de mobilité
Etude de Snodgrass2012:
Dans cette revue systématique déjà analysée auparavant figure un chapitre sur la mesure de la rigidité vertébrale, y est discuté ici la fiabilité et la validité de celle-ci. Les auteurs soulignent que de nombreux facteurs peuvent interférer cette mesure et que ceux -ci ne sont bien souvent pas contrôlés, comme la quantité de force appliquée, l’aire de contact de la main, et la position de celle-ci, ou encore la position du sujet et la rigidité de la table.

Le tableau 4 mis en évidence par Mr Trudelle fait référence à une validité diagnostique pathologique avec mise en évidence d’une instabilité radiologique ou d’une atteinte des processus articulaires postérieurs. Les auteurs concluent ici que les valeurs clinimétriques sont faibles : « The small likelihood ratios reported in clinically representative populations suggest limited diagnostic utility of spinal stiffness for these target diagnoses »
Cette étude est en accord avec nos propos.
Etude de Koppenhaver2014 :
Nous citons cette étude dans le cadre suivant : « La rigidité vertébrale, c’est-à-dire la relation entre la force appliquée par le praticien sur la vertèbre et le déplacement de celle-ci, jugée par le praticien, n’est pas associée aux résultats radiographiques sur les mobilités en rotation (Snodgrass 2012) ainsi que sur les PA (poussées postéro-antérieure), et ce sur différentes zones vertébrales (Koppenhaver 2014). »
C’est une étude transversale ayant pour objectif d’évaluer la validité de l’évaluation de la rigidité segmentaire lombaire. C’est la première étude de validité portant sur des sujets symptomatiques, les auteurs soulignent que le souci des études de validité est le gold standard : l’imagerie ne mesurera que la mobilité segmentaire alors que les thérapeutes, par leur examen manuel sont soumis à un facteur confondant de tailles : la résistance à leur pression, qui peut biaiser leur jugement sur la mobilité. Le gold standard choisi par les auteurs est donc novateur puisqu’il prend en compte et la mobilité et la résistance vertébrale et est donc comparable à l’évaluation manuelle faite par les thérapeutes, d’où le choix de cette étude, on parle ici de mesure de l’indentation vertébrale.
Cette mesure est une mesure linéaire, donc réalisée par l’intermédiaire de poussée postéro- antérieure (PA).
Les valeurs clinimétriques sont faibles, comme le rapporte le tableau que nous avons mis en évidence dans l’article. Ce tableau rapporte seulement les valeurs de validité concernant l’hypomobilité, MrTrudelle qui ne s’est contenté que de la lecture du résumé pour émettre un jugement s’interroge sur pourquoi cet article n’a pas calculé les valeurs clinimétriques de l’hypermobilité, il aurait eu sa réponse en lisant l’article dans son intégralité : « Additionally, since judgements of hypermobility were relatively infrequent (5 out of 50 participants) we limited our sensitivity, specificity, and likelihood ratio analyses to hypomobility rather than performing them on both hypomobility and hypermobility. Although this limits us from making quantitative conclusions about diagnostic utility of judgements of hypermobility, the graph of assessments of each participant (Figure 3), suggest that manual judgements of spinal stiffness are poor discriminators of criterion stiffness, regardless of the category breakdown. »
Les valeurs rapportées sont extrêmement variées et soulignent une validité faible pour l’hypermobilité, voici la figure 3 de l’article :
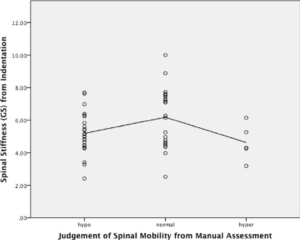
Cette étude est en accord avec nos propos.
Mr Trudelle nous propose ensuite les deux études rapportant les résultats les plus éloquents incluent dans la revue systématique de Snodgrass pourquoi nous proposer celles-ci et pas les autres ? De nombreuses études citées par Mr Trudelle vont ensuite être analysées ici.
Etude de Stolz2020 :
L’étude de Stolz 2020 est une étude récente qui n’était pas encore accessible au moment de la rédaction de notre article. Elle semble pertinente pour notre sujet, analysons-là:
A la lecture du résumé, nous pouvons noter que c’est une revue systématique qui à inclue 13 études portant sur la fiabilité et la validité des PAIVM’s , des PPIVM’s et du test d’instabilité sur le ventre (PI) dans la région lombaire, ce qui est en accord avec le sujet de notre article. Cette étude semble confirmer les propos que nous rapportons dans notre article « The evidence regarding validity and reliability of segmental motion testing is poor and clinical use of stand-alone tests cannot be recommended »
La qualité méthodologique est bonne, les auteurs ont suivi les recommandations PRISMA, ont enregistré leur protocole sur PROSPERO, les critères d’inclusion et d’exclusion sont bien décrits ainsi que les techniques analysées. Ils ont procédé à une évaluation de la validité interne réfléchie en adaptant le Qarel (bien décrit dans le protocole). La justification des recommandations effectuées en conclusion est clairement explicitée dans la méthode effectuée pour procéder à ces recommandations. Il est toutefois à souligner que la description claire de ce qu’entendent les auteurs par hyper mobilité ou hypo mobilité ou encore instabilité n’est pas présente ce qui est un biais à l’étude, on ne connait seulement que le Gold Standard. La recherche électronique n’a été effectuée que par une seule personne ce qui peut poser problème.
La méta analyse n’a pas été effectué compte tenu de l’hétérogénéité des Outcomes
Les auteurs ont inclus dans leur analyse l’étude de Abbott2005 citée par Mr Trudelle précédemment. Elle traite de la validité des PPIVM sur des patients lombalgiques. La spécificité du test est élevée (0,99-1,0) mais la sensibilité extrêmement faible (0,03-0,07). Par manque de cohérence externe de faibles recommandations sont proposées pour détecter une instabilité lombaire mais ce test n’est pas recommandé pour exclure une instabilité lombaire. Les autres études portant sur les autres tests se ressemblent dans leurs résultats. Aucun autre test dans les études inclues ne présente une bonne sensibilité, nous voilà donc bien avancé….
Pour ce qui est de la fiabilité, l’étude est cohérente avec nos propos. Les auteurs concluent que les valeurs clinimétriques de fiabilité sont trop faibles pour recommander ces tests afin de détecter une hypo mobilité ou une hyper mobilité lombaire. Le PAIVM présente des résultats meilleurs mais contradictoires lorsque l’on se base sur la reproduction de symptômes pour évaluer la fiabilité inter évaluateur (k :0,14-0,69), ce qui est cohérent avec les autres études sur le sujet
Cette étude est pertinente et en accord avec les propos que nous rapportons dans l’article.
L’étude de Fritz2005 est proposée ici par Mr Trudelle « Concernant l’hypermobilité/instabilité, pourquoi ne pas citer Fritz (48) et le tableau 2 ? C’est une étude positive et intéressante. » A revoir c’est encore une étude différente de fritz
Etude de Jull1988 :
C’est une étude diagnostique en cross-over, c’est-à-dire que les patients ont pour certains reçu le diagnostic médical ( gold standard par bloc facettaire) puis le diagnostic kinésithérapique basé sur les PAIVM avec perception de raideur, sensation de fin de course et reproduction de douleur et vice versa pour le second groupe.
Les résultats et les valeurs clinimétriques à en tirer sont excellentes.
Toutefois, le protocole a été modifié au cours de l’étude ce qui est un biais important : « However, in the course of the study it was found that this intention had to be compromised in deference to the high « irritability » of the pain in many subjects. Many of the patients could not tolerate a full examination of every joint movement. Therefore, it was decided to assess, at the minimum, the passive, accessory intervertebral movements in all subject ».
Les valeurs clinimétriques rapportées englobent la totalité de l’examen, à la fois subjectif et objectif, et non seulement des tests cibles.
Concernant l’aveuglement des sujets et thérapeutes, le protocole n’est pas clair : « and were then referred, on a single-blind basis, for examination by a manipulative therapist. ».
On ne sait pas si ce sont les patients ou le thérapeute qui est en aveugle. Ceci est un biais énorme qui peut fortement sur évaluer les résultats, l’idéal aurait été ici un double aveugle qui aurait pût être réalisé facilement.
Et surtout, le Gold Standard ici est une injection par bloc facettaire, ce qui rend l’étude hors sujet ! En effet aucun moyen de savoir si ces valeurs retrouvées sont du fait d’une bonne validité ou non de la mobilité des vertèbres cervicales puisque seule leur réponse à un anesthésiant est évaluée ici…
Malgré un réel argument d’autorité employé par mr Trudelle « l’étude mondialement citée de Jull » cette étude n’est pas pertinente dans l’appel de texte et de plus présente de nombreux biais.
Regardons enfin les 4 dernières études appelées dans cette partie du texte de la relecture de Mr Trudelle. Les trois premières ( Hall2007,Hall2008, Ogince2008) portent sur la région cervicale haute (C1-C2).
Etudes de Hall2008 et Ogince2008 :
Hall2008 et Ogince2008 s’intéressent au valeurs clinimétriques du test de Flexion Rotation afin de diagnostiquer une dysfonction C1-C2 sur des personnes souffrant de céphalées cervicogénique (population incluse mixée avec des patients asymptomatiques et des patients symptomatiques mais sans dysfonction C1-C2).
Ces 2 études sont hors sujet et ce pour deux raisons :
- Le test de flexion-rotation ne cherche pas à évaluer et quantifier la perte de mobilité d’une vertèbre spécifique dans un mouvement physiologique ou accessoire, son objectif est de voir si l’amplitude de mouvement en rotation position de tête en flexion maximale est diminuée par rapport au coté opposé ou par rapport à une norme (rotation inférieure à 34°). Aucune imagerie n’est effectuée ici pour évaluer la mobilité vertébrale qui est réellement présente ici et confirmer s’il y a réellement une perte ou non de mobilité. D’ailleurs le test s’arrête et l’amplitude de mouvement est mesurée par le thérapeute lorsque le patient rapporte une douleur.
- Absolument rien n’indique que les patients souffrent ici d’un réel défaut d’hypermobilité, d’hypo mobilité ou d’une quelconque dysfonction cynésiologique. L’évaluation et l’inclusion des patients symptomatiques est basé sur les critères de l’IHS et du « Cervicogenic Headache International Study Group » qui sont des critères issues de l’interrogatoire du patient et de l’examen clinique. Les patients symptomatiques sont ensuite sous groupés en deux catégories, les patients présentant une dysfonction C1-C2 et les autres. Ce sous groupage est effectué via… un examen manuel !
Les propos rapportés par les auteurs dans cette étude peuvent paraître vraiment préoccupants, à première vue, on ne peut pas dire ici que le test est valide pour diagnostiquer une céphalée cervicogénique en lien avec une dysfonction C1-C2 puisque pour cela , selon les critères de l’IHS il faut que celle-ci soit dû à des structures provenant de la colonne vertébrale supérieure :
« The IHS1 defined CeH as head pain, referred from a source in the neck that may arise from a variety of upper cervical spine structures ».
Or ici aucune mesure en lien avec l’imagerie ou objectivant le fait que les symptômes et éléments cliniques proviennent de cette région n’ont été effectués pour objectiver cela. Les seules conclusions que l’on peut tirer est que le test de flexion rotation de tête est cohérent avec d’autres tests et informations collectés lors de l’interrogatoire par d’autres thérapeutes ce qui est déjà une très bonne chose.
Si l’on prend un angle différent, on peut aussi voire que certaines études citées par Ogince rapportent que ni l’imagerie ni les blocs facettaires n’aident au diagnostic : « Radiological examinations are not effective (Jensen et al., 1990; Edmeads, 2001), and nerve block procedures are often impractical, particularly in the upper cervical region (Bogduk et al., 1985). »
Cet angle de vue justifie alors le design de l’étude et les conclusions rapportées par les auteurs. Mais ici aussi, il est impossible d’affirmer un quelconque lien entre hypo mobilité, hypermobilité ou autre dysfonction cinésiologique vertébrale, ni toutes autres formes de défauts structurels ou biomécaniques
Finalement ce qui est le plus intéressant ici est que les auteurs ne retrouvent pas de différences dans les résultats entre les praticiens expérimentés et non expérimentés
L’étude citée par Mr Trudelle n’est pas pertinente pour le sujet traité.
A ce titre l’étude de Schaffer et al publiée en 2018 aurait pu être plus pertinente, on y reviendra dans un prochain article. https://pubmed.ncbi.nlm.nih.gov/29308957/
L’étude de Ogince2008 présente, à l’exception de quelques différences un protocole équivalent qui amène à des propos identiques de notre part.
Toutefois une différence notable nous semble importante à signaler : ici le test de flexion rotation n’est pas réalisé de la même manière, en effet le thérapeute ne prend pas en compte la douleur du patient pour déterminer l’amplitude en rotation il se base sur son ressenti de fin de course et de raideur dans le mouvement. Toutefois, ici encore ce ressenti ne peut être objectivé par un Gold Standard et demeure bien que concordant avec les éléments cliniques qui ont amené à l’inclusion des patients dans le groupe céphalée cervicogénique, théorique.
L’étude citée par Mr Trudelle n’est pas pertinente pour le sujet traité.
L’étude de Hall 2007 porte sur le traitement des céphalées cervicogénique, elle est comme les précédentes hors sujet.
Ici des patients présentant des critères cliniques et issues de l’interrogatoire ont été recrutés en tant que population présentant une céphalée cervicogénique avec dysfonction sur C1-C2. Ils ont été randomisés dans deux groupes, un groupe placebo et un groupe actif (mobilisation Snag : self-sustained natural apophyseal glide, sur C1-C2). Ici encore aucune mesure n’a permis d’objectiver un réel défaut de mobilité vertébrale dans la zone de C1-C2.
Les auteurs ont retrouvé une différence significative entre le groupe placebo et le groupe actif. On peut noter qu’aucun critères de jugement principal n’a été déterminé au préalable (on a ici deux critères de jugements différents mesurés sur deux périodes de mesures différentes), et que les auteurs ne rapportent pas un enregistrement au préalable sur clinical trials (ou la publication en amont de l’étude du protocole).
On peut aussi noter la nature du placebo qui fera écho ici à notre article numéro 2 (titré : Trouver de la certitude dans l’incertitude des effets de la thérapie manuelle, Henry2020), dans cette étude le placebo reprend juste la participation active du patient, le matériel ( a cervical self-SNAG strap (Manual Concepts, Booragoon, Australia)) et la zone d’appui de celui-ci , « The strap was positioned as previously described. The subject was then asked to apply a 3-second sustained forward pressure at C1, without moving the head ».
La différence avec le traitement actif est que le patient ne tourne pas la tête lors de l’appui et ne reçoit pas de thérapie manuelle par le thérapeute, contrairement au groupe actif : « The treating therapist assisted with positioning of the strap and applied end range overpressure in rotation. »
La différence pourrait-elle donc ici, être due aux effets non spécifiques du toucher ? La question est posée !
Cette étude citée par Mr Trudelle n’est pas pertinente pour le sujet traité.
Pour terminer la relecture du paragraphe numéro 5, Mr Trudelle finit de la manière suivante « Il faut aussi contextualiser l’examen clinique. Par exemple, lorsqu’un patient a été opéré du genou et qu’il a des limitations de mobilité. Le kinésithérapeute essaye de comprendre si les freins sont liés à des défenses musculaires, des problèmes de mobilité spécifique. Il n’y a pas d’étude spécifique pour le moment car c’est une pratique régulière d’essayer de cibler ce que l’on souhaite améliorer en essayant d’en déterminer des causes spécifiques pour chaque patient. Les tests sont alors développés comme récemment le LOE test pour le genou (53). » Nous ne comprenons pas les propos rapportés. Le fait qu’une pratique régulière ne puisse pas être étudiée au sein d’un protocole est un non-sens, c’est le principe de la recherche clinique.
Analysons donc l’étude de Salvi2013 en lien avec la phrase citée précédemment.
Etude de Salvi2013 :
Les auteurs évaluent les propriétés clinimétriques du test LOE (test de perte d’extension du genou) afin d’objectiver une rupture (ou une laxité pathologique) ou non du ligament croisé antérieur. Les auteurs retrouvent une validité intéressante de ce test.
L’étude est hors sujet :
- Ici est mesuré l’extension de genou (cf photo), on ne peut déterminer avec certitude les facteurs limitants et la mobilité articulaire présente au sein du genou
- On ne peut pas déterminer la structure responsable de cela, en effet les auteurs font l’hypothèse que cela pourrait être dû à la translation antérieure du tibia contre le fémur consécutive de la déchirure du LCA qui réduirait l’extensibilité de la capsule postérieur du genou. Or ceci reste une hypothèse, nous pouvons aussi imaginer d’autres facteurs confondants qui pourrait limiter l’extension du genou : l’hypertonie des ischios jambiers présente lors des AMI du quadriceps (inhibition arthrogénique musculaires) que l’on retrouve sur des patients ayant subi un traumatisme du genou, le gonflement du genou ou encore l’appréhension du sujet.
Un test peut donc présenter de bonnes propriétés clinimétriques en termes de sensibilité et de fiabilité pour déterminer une atteinte structurelle grâce à des facteurs confondants, sans pour autant que ce test permette en lui-même d’objectiver la nature de la limitation d’amplitude.
Cette étude citée par Mr Trudelle n’est pas pertinente pour le sujet traité.
- Direction spécifique à appliquer sur une hypo-mobilité
Neumann2012 : Cette référence est effectivement un éditorial d’une sommité sur le sujet. Tout d’abord nous remercions Mr Trudelle pour les liens vers le dernier ouvrage de Neumann et vers les vidéos arthrocinétiques très instructives et de très bonne qualité que vous pouvez retrouver ici : https://coursewareobjects.elsevier.com/objects/elr/Neumann3e/mobileresources/chapter05/ .
Mr Trudelle est surpris par notre interprétation de l’éditorial. Paraphrasons notre texte : nous résumons que les règles « concave sur convexe » pourraient sur certaines articulations s’appliquer d’un point de vue observationnel, c’est-à-dire que si l’on ne fait rien et qu’on observe sous imagerie ce qu’il se passe on pourra valider ces règles (même si l’on observe quasiment aucun mouvement ! Vous pouvez lire l’éditorial pour comprendre pourquoi.). Cependant l’appliquer en pratique clinique ne serait pas d’une grande utilité. Ce sont les propos faits par Neumann : « My rebuttal to this argument is that the convex-concave rule was never intended to establish the direction of a manual glide, applied at a joint, that would best increase a targeted movement. The rule merely describes the arthrokinematic pattern that minimizes the inherent migration of the center of the convex member in the direction of the roll. »
Mr Trudelle dit que leur utilisation dépend des buts que l’on se fixe, ce qui pose un problème puisque ces règles sont utilisées afin de réaliser un gain d’amplitude. Dans les études que nous avons citées ensuite où il a été comparé le gain d’amplitude entre mobilisations suivant la règle concave sur convexe vs l’inverse, les auteurs ont juste signalé que l’objectif était un gain d’amplitude sur une articulation donnée et non un étirement ligamentaire comme cela est spéculé par Mr Trudelle. Le fait d’étirer un ligament pour gagner de l’amplitude et qui pourrait expliquer les meilleurs résultats en glissement post pour un gain d’amplitude en rotation latérale d’épaule sur l’étude de Johnson est spéculatif, c’est une hypothèse formulée par Neumann et reprise par Mr Trudelle.
Cet éditorial est en accord avec nos propos.
Ludewig et Deutsh : Ces deux études sont citées en tiroir en adéquation avec les propos recueillis par Neumann
Etude de Joseph : L’article de Joseph est bien une revue de pratique proposant un outil décisionnel concernant la perte d’amplitude au niveau du genou.
Etude de Johnson :
Cette étude est citée dans le cadre suivant : « Le Glissement postérieur serait plus efficace que le glissement antérieur pour regagner en rotation latérale (Johnson 2007). Ou encore, au niveau du genou, le glissement postérieur du fémur serait plus efficace que le glissement antérieur pour regagner en flexion (Scarvell2018) »
Cette étude est un essai contrôlé randomisé. Mr Trudelle fait une erreur sur les objectifs de l’étude, il rapporte que « C’est pour des épaules gélées et le but est de faire des étirements capsulo-ligamentaires et non de restaurer une mécanique articulaire perturbée (comme lors d’un changement d’axe de rotation instantanée) ». Ce n’est pas cela. L’objectif ici est de comparer deux techniques de mobilisations qui sont basées sur des prémices différents :
- Gain de rotation latérale avec glissement antérieur, qui se base sur la règle concave sur convexe
- Gain de rotation latérale avec glissement postérieur, qui se base ici sur le principe d’étirement capsulo-ligamentaire.
Deux modèles théoriques et explicatifs s’affrontent ici sur une population spécifique : les capsulites rétractiles.
On retrouve une amélioration plus importante sur le groupe ayant reçu un glissement postérieur. Que conclure ?
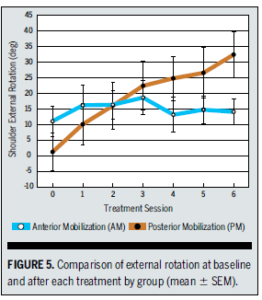
Cela ne valide aucun modèle théorique, on ne sait pas pourquoi ce gain de rotation latérale est plus important avec un glissement postérieur. Aucune mesure de l’extensibilité, de la longueur des éléments capsulo-ligamentaire n’est rapportée dans cette étude, aucune observation arthrocinétique n’est effectuée pour voir ce qu’il se passe lors des mobilisations. En revanche l’information à tirer ici, est qu’utiliser les règles arthrocinétiques dans une logique de gain d’amplitude n’est pas toujours pertinent.
La question même d’une direction spécifique pour un gain d’amplitude donnée se pose clairement dans le sens ou le glissement postérieur aide aussi à regagner en rotation médiale
« This result is consistent with the findings of Roubal et al54 and Placzek et al,47 who with a posterior gliding manipulation found marked increases in external rotation as well as internal rotation »
Cette étude est en accord avec nos propos.
Toutefois il semble difficile à partir de ces données de généraliser cela à toutes les populations sur toutes les articulations.
Etude de Scarvel2019 : Sur cette étude il est reproché par Mr Trudelle que les conclusions portant sur la règle concave- convexe ne peuvent être tirées car il n’y a pas de point fixe.
Tout d’abord nous sommes étonnés par cette affirmation, aucune référence ni citation n’accompagne ses propos. De plus sur bien des mobilisations cette règle est appliquée sans contre prise. Les observations de cette règle arthrocinétique est aussi réalisée sur des mouvements sans contre prise et donc sans point fixe, vous pouvez observer cela sur le lien fourni par Mr Trudelle : (https://coursewareobjects.elsevier.com/objects/elr/Neumann3e/mobileresources/chapter05/).
En ce sens nous ne comprenons pas pourquoi cette étude ne serait pas valide pour justifier nos propos. Nous nous sommes donc penchés sur comment Kaltenborn utilise cette règle pour un gain de flexion du genou. Et en effet on retrouve un point fixe du fémur.
Figure issue de Manual Mobilization of the Joints The Kaltenborn Method of Joint Examination and Treatment. 2002.
Pour autant est- ce vraiment pertinent ? Y’a-t-il eu des essais réalisés comparant le gain d’amplitude en flexion à la suite d’une mobilisation sur une position fonctionnelle en squat vs une mobilisation type Kaltenborn avec un point fixe sur table ? Pas à notre connaissance…
De plus affirmer qu’il n’y a pas de point fixe semble présomptueux, on pourrait tout à fait envisager que le tibia du fait de la flexion dorsale de cheville réalisée durant le squat soit fixe sur une bonne partie de la fin de mouvement réalisé lorsque la flexion dorsale est au maximum. Ceci reste une hypothèse que nous prenons le soin de ne pas transformer en affirmation, en effet les modélisations rapportées dans l’étude ne portent que sur le fémur par rapport au tibia. Il n’y a pas de modélisation du fémur ou du tibia par un point fixe alternatif.
Enfin si vous êtes intéressés par le sujet nous vous conseillons la vidéo de Fabrice Barillec réalisée pour les Euro Physio sur le sujet : https://www.youtube.com/watch?v=mi64hzlxicA&fbclid=IwAR29XFskR9vnWwFZP8R6LIJlGI0ya5h2CNF3_uNx1ExraS4Y5bk-eTIdE5A. Cette excellente vidéo a été mise en ligne postérieurement à la publication des 3 articles de notre série sur Kinéfact. Il est très intéressant de constater que les études citées sont sensiblement identiques aux nôtres ce qui montre que les données scientifiques sur cette thématique pourtant incontournable en pratique et en formation initiale manquent cruellement de données probantes.
L’étude de Scarvel est donc en accord avec nos propos.
Etude de Villafane2011 :
Mr Trudelle cite cette étude pour justifier l’utilité et le procédé des mobilisations Kaltenborn ( avec les règles concaves sur convexe)
Cette étude est très intéressante à analyser. C’est un ECR, il porte sur des patientes ayant une rhizarthrose symptomatique (âge entre 70 et 90 ans avec des critères d’inclusions et d’exclusions spécifiques et cohérents, groupe comparable à la baseline)
L’étude est présentée comme un ECR en double aveugle, pourtant les seules en aveugle sont les thérapeutes qui effectuent le traitement vis-à-vis des données du bilan (et non du traitement effectué) et les thérapeutes qui analysent les données de traitement récolté. Les thérapeutes ne sont donc pas en aveugle sur le traitement qu’ils effectuent et on ne sait pas si les patients le sont, d’ailleurs on ne sait pas si l’aveuglement est contrôlé et maintenu.
L’intervention consiste en des mobilisations types Kaltenborn sur 6 sessions durant 3 semaines. Nous n’observons pas de « wedges » comme cela est rapporté par Mr Trudelle dans cette étude. Toutefois cette étude reste intéressante pour notre sujet puisque les mobilisations Kaltenborn de l’intervention ont pour principe fondamental la règle concave sur convexe.
Au niveau des résultats, il y avait 5 critères de jugement récoltés sur 3 périodes de temps différents, aucun des critères n’a été défini comme critère de jugement principal. Ces critères portaient sur la douleur et sur la force
Le seul critère statistiquement significatif entre les deux groupes était la diminution de la douleur 5 min après l’intervention sur le PPT (pressure pain threshold) au niveau de l’articulation trapezo- métacarpienne ( ce n’était pas significatif au niveau du PPT du scaphoïde).
Les groupes de traitement ont reçu le même nombre d’interventions.
Les résultats ne sont donc clairement pas éloquents, on ne peut pas noter non plus de différence cliniquement significative. Le plus problématique ici, est la nature du placebo, ce n’est pas un placebo de thérapie manuelle ici, les patients ont reçu une séance de 10min d’ultrasons. Ce type de placebo entraîne une sur estimation de la taille de l’effet et facilite des différences statistiquement significatives (Henry2020 :article 2 de la série Kinéfact). Malgré cela ce n’est pas le cas ici, on peut donc légitimement se questionner sur l’intérêt de ce type de mobilisation. La conclusion des auteurs de cet article nous semble extrêmement orientée et biaisés
« This study showed that Kaltenborn manual therapy decreased pain in the CMC joint and scaphoid bone areas of elderly female patients; however, it did not confer an increase in motor function in patients with CMC »
L’étude citée par Mr Trudelle est pertinente, mais ne présente pas de “wedges” et ne convient donc pas à son appel dans les références. De plus, elle semble en accord avec nos propos dans le sens où elle ne montre presque aucune supériorité de ce type de mobilisation comparé à un placebo d’ultrasons.
6. Force spécifique
Harms1997 : C’est l’une des deux études qui a été omise d’être appelée dans les références comme l’a souligné Mr Trudelle, nous nous en excusons.
L’étude est bien en accord avec nos propos. Il existe une grosse variabilité sur le même grade (et ce quelque soit le grade) tant sur la force appliquée que sur la fréquence de pression appliquée.
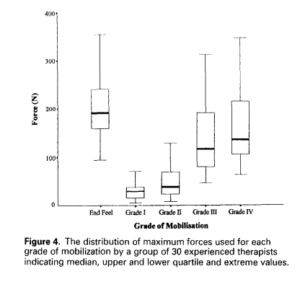
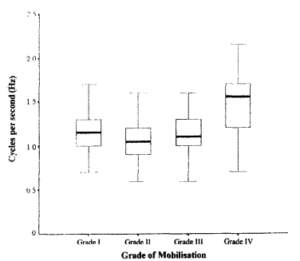
Chiradjenant2002 :
Mr Trudelle nous demande pourquoi cette étude précédemment commentée n’est pas reprise dans cette partie de l’article. Cette étude n’est pas du tout commentée dans notre article. Il doit y avoir confusion. Toutefois analysons-la.
Cette étude porte sur des patients lombalgiques et l’évaluation de la force exercée par des praticiens sur des PA lombaires, elle est pertinente, elle est aussi cohérente avec les données fournies par les autres études que nous avons citées. Voici un graphique qui illustre bien cela :
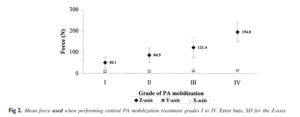
Alors pourquoi ne pas l’avoir incluse dans notre article ? Tout simplement car notre article n’est pas une revue systématique et que nous ne sommes pas tenus d’inclure toutes les études pertinentes sur le sujet. Il se peut aussi que nous soyons passés à coté dans la recherche des études sur le sujet par le caractère non systématique de la recherche.
Cette étude citée par Mr Trudelle est pertinente, elle renforce nos propos et est en accord avec ceux-ci, en soi elle n’a aucune conséquence sur les propos que nous avons tenu à ce sujet.
Etude de Herzog2010 :
C’est une étude réalisée par un chiropracteur. Nous ne reviendrons pas sur ce que nous pensons de la discrimination de lecture d’article opérée par Mr Trudelle sur les articles issus de cette profession. Cet article est une revue narrative qui tout comme la nôtre s’intéresse à plusieurs aspects biomécaniques de la manipulation dont notamment la force exercée. A ce titre la figure qui suit le texte est bien tirée de cet article, toutefois les auteurs l’ont reprise de l’article de Forand (Forand2005).
Cet article est bien en accord avec nos propos.
Mr Trudelle affirme que « l’auteur cite Herzog (63) qui est une étude de chiropraticien. Nous ne commenterons pas le travail d’une autre profession. D’autant que la force appliquée pour une manipulation est un grade 5. Ce n’est pas une évaluation de grade car tout le monde est en grade 5 à ce niveau » Cette phrase résulte probablement d’une incompréhension. Il n’est pas ici dit que c’est le grade qui doit être déterminé. Il est ici évalué la variabilité de force au sein d’un grade sensé être standardisé. Et cette étude montre bien que selon le praticien la force exercée dans un thrust peut aller du simple au double, ce qui est une grosse variabilité et pourrait conduire à des effets ou encore à une exposition au risque différents.
Etude de Gorgos2014 :
L’étude de Gorgos est une revue systématique portant sur l’analyse inter-évaluateur et intra-évaluateur de la fiabilité de la force exercée par le thérapeute lors de la mobilisation d’une articulation avec un grade de force précis.
Les auteurs ont pour résultat :
- Une recommandation à fort niveau de preuve d’une fiabilité inter-évaluateurs très faible à modérée.
- Une recommandation à fort niveau de preuve d’une fiabilité intra-évaluateur forte à très forte, ce qui est en accord avec les propos rapportés dans notre article.
Lorsque l’on regarde la qualité méthodologique de cette revue, celle-ci parait à première vue bonne : les lignes directrices PRISMA semblent appliquées. Les critères d’inclusions (notamment le fait que les études doivent être centrées sur l’humain et non sur des modèles in vitro qui rapportent généralement de meilleures valeurs clinimétriques sur ce type de test) sont pertinents.
Toutefois on notera l’absence de description des différentes techniques utilisées. Ce qui rend difficilement interprétable les différentes informations. On notera aussi que l’analyse de sensibilité (c’est-à-dire la réinterprétation des données en ne prenant en compte que certains critères, ici les études incluses avec une meilleure validité interne) font considérablement baisser le niveau des recommandations, que cela soit en inter ou en intra évaluateur. A l’exception d’une étude incluses, les différentes études portent sur des sujets asymptomatiques.
Il est a noter que nous ne comprenons pas pourquoi certaines études n’ont pas été intégrées dans la revue systématique comme celle de Matyas et al (Matyas, T. A. and Bach, T. M. The reliability of selected techniques in clinical arthrometrics. Australian Journal of Physiotherapy, 1985, 31, 175-1999) alors que les critères d’inclusions et d’exclusions semblent en accord avec cette étude.
Il est aussi dommage d’avoir limité les études présentant un ICC interprétable, ce qui empêche l’inclusion d’étude pertinente pour le sujet comme celle de Chiradjenant2002 et de Harms1997
Finalement les auteurs concluent de la manière suivante « Although adequate intra-clinician reliability was established, the validity of the forces used during the joint mobilizations cannot be determined. Overall, both intra-clinician and inter-clinician force applications need to be re-evaluated as new instructional methods and research evidence become available. »
Nous sommes bien d’accord avec cette affirmation, le fait que la fiabilité intra-évaluateur soit bonne semble être un maigre lot de consolation.
Cette étude citée par Mr Trudelle est pertinente et en accord avec nos propos.
Nous proposons donc de compléter notre texte de la manière suivante :
« Une revue systématique de Gorgos et al a compilé les données clinimétriques sur le sujet. Elles concluent qu’en inter -examinateur la fiabilité est faible à modérée alors qu’en intra -examinateur celle-ci est bien meilleure, allant selon les études de fortes à très forte. Toutefois, compte tenu de la faible validité du recueil spécifique de la force exercée et de la faible fiabilité inter-examinateur, nous pouvons légitimement nous interroger sur l’intérêt et la possibilité de mobiliser à une force donnée spécifique ou standardisée. En pratique clinique, adapter sa force au ressentie du patient peut peut-être être un atout, mais de là à standardiser et quantifier celle-ci, il y ‘a une grande différence”.
Etude de Snodgrass2006 :
Cette étude n’a pas été rediscutée c’est une revue narrative essentielle pour la compréhension des différents facteurs explicatifs pour l’hétérogénéité des études sur le sujet (outils de mesure de force, variable de mesure, etc ) mais aussi sur la fiabilité inter-évaluateur faible ( expérience, surface appliquée, population cible, etc).
C’est la deuxième étude qui n’a pas été appelée dans les références nous nous en excusons.
Cette étude est en accord avec nos propos.
- Point d’application spécifique
De nombreuses études vu dans le chapitre 1 : Association mobilité symptômes ont montré qu’il n’y avait pas vraiment d’intérêt à mobiliser ou manipuler une zone donnée, précise.
Le chapitre ici cherche à comprendre ce qu’il se passe localement d’un point de vue arthrocinétique, lorsque nous mobilisons ou manipulons.
Etude de Ross2004 :
C’est une étude expérimentale descriptive faite par des chiropraticiens. 28 chiropraticiens ont effectué des manipulations sur 64 sujets asymptomatiques pour un total de 17 manipulations thoraciques et 54 manipulations lombaires. C’est le bruit de la cavitation qui a été recueilli ici et qui a permis de déterminer la localisation de celle-ci lors de la manipulation. A ce sujet les recueils de mesures sont bien décrits dans l’étude, ainsi que la procédure manipulative et le raisonnement clinique qui a conduit les praticiens à effectuer telle ou telle manipulation.
Seulement 36,5% des manipulations lombaires ont abouti à une cavitation sur un seul étage. Pour les autres cela variait de 2 à 6 cavitations sur des étages différents pour une seule manipulation.
L’erreur de ciblage par rapport à la manipulation recherchée était en moyenne de 5,29cm allant de 0 à 14cm pour les valeurs les plus extrêmes.
Cette étude est en accord avec nos propos, elle montre bien que lorsque l’on cherche à être spécifique sur une manipulation, nos effets arthrocinétiques risques d’être plus étendus que prévu et pas forcément au bon endroit.
Relevons toutefois qu’il semble y avoir quand même une association entre l’étage ciblé et le bruit de la cavitation, en effet plus la vertèbre cible est loin de L1 plus la cavitation sera loi n de L1 et ce dans le cadre d’une cavitation unique ou de multiples cavitations.
Cette figure illustre bien cela (à gauche cavitation simple en lombaire, à droite multiples cavitations et cavitation simple en thoracique) :
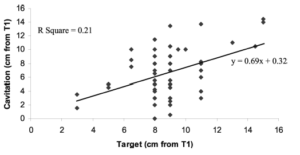
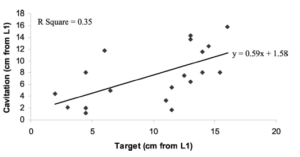
Etude de Kulig2004 :
C’est une étude expérimentale descriptive réalisée par des physiothérapeutes sur des sujets asymptomatiques. 20 sujets ont été mobilisés par un seul thérapeute expérimenté avec contrôle de la mobilité par IRM. Cette mobilisation était standardisée, un seul essai était effectué sur chaque étage lombaire. Il est a noté qu’un grade IV Maitland était réalisé, mais compte tenu de la description du protocole, cela semble plus correspondre à un grade III
« The force was applied slowly (approximately 1-2 seconds) and held at end range for at least 5 seconds. Release of the force also occurred slowly (1-2 seconds) before moving to the next vertebral level »
Comme rapporté dans notre article cette étude montre que la force exercée sur une vertèbre entraine le mouvement de plusieurs vertèbres et est projetée sur une grande surface.
Mr Trudelle avance que « le mouvement est plus important sur l’étage ciblé. Ce n’est pas une surprise pour ce type de mobilisation et c’est ce qui est recherché avec une emphase de l’étage… »
Nous sommes bien d’accord là-dessus, et l’image tiré de Kulig et al que nous avons mise en évidence dans notre article le montre bien. Toutefois on peut aussi souligner que cette mobilité des vertèbres alentours ne suit pas « une loi normale » et diffère selon l’étage mobilisé Il est donc difficile de déterminer comment va bouger l’étage cible et comment vont bouger les étages sus et sous-jacents (voir la figure ci-dessous).
Cette étude est en accord avec nos propos.
Nous proposons de compléter notre article de la manière suivante :
« La force appliquée se projette en réalité sur une grande surface, jusqu’à 14 cm du site (Ross 2004)
Bien que la force appliquée sur la vertèbre cible lors de PA lombaires soit plus importante que sur les autres vertèbres, la mobilité des vertèbres alentours ne suit pas « une loi normale » et diffère selon l’étage mobilisé. Il est donc difficile de déterminer comment va bouger l’étage cible et comment vont bouger les étages sus et sous-jacents. » (Kulig2004)
Etude de Powers2002 :
Mr Trudelle nous propose cette étude descriptive du même groupe de recherche que celle de Kulig et al pour compléter la discussion.
C’est une étude antérieure à la précédente avec quasiment le même schéma d’étude. Finalement l’étude est cohérente avec celle de Kulig2004 et n’apporte pas de nouveaux éléments à l’article.
Cette étude citée par Mr Trudelle est pertinente et en accord avec nos propos
Exception qui confirme la règle, nous nous sommes tenus à discuter et analyser que les sujets de fonds de la relecture de Mr Trudelle, mais nous aimerions que vous puissiez apprécier la rhétorique et le raisonnement de Mr Trudelle « L’auteur nous fait cadeau d’une dernière information sur l’impact du bruit déclenché par la manipulation sur la mobilité en citant quelques références que je ne commenterais pas étant moi-même auteur d’un tuons les mythes sur ce sujet en 2004 (69), il y a plus de 16 ans…Quel scoop ! »
Mr Trudelle sous prétexte qu’il à rédigé un article sur ce sujet en 2004 considère donc qu’il n’y a finalement plus aucune discussion à avoir sur ce sujet et ne prend donc pas la peine de commenter ( et de lire ?) les articles que nous avons cités.
Nous n’avons pas réussi à nous procurer l’article de Mr Trudelle, toutefois des slides résumés de celui-ci sont proposés par l’auteur ici : https://fr.slideshare.net/Pierretru/bruit-trudelle
D’après lecture des slides seul le phénomène de cavitation est employé, il n’y aucune mention du phénomène de tribonucléation
La recherche évolue depuis 2004, et des données récentes peuvent apporter de nouvelles informations et infirmer les précédentes.
Pour terminer sa relecture Mr Trudelle cite en le nommant explicitement un article de chiropraticien, un comble alors qu’il n’a pas voulu lire et analyser les données provenant d’auteurs issus de cette profession.