Bryan Littré est un kinésithérapeute passionné par l’utilisation de la science dans la pratique clinique. Il a pour domaine d’expertise les douleurs dites neuropathiques, pour lesquelles il a déjà publié une revue systématique (Littré, B. (2018). Neurodynamique et neuropathie compressive du membre supérieur : revue systématique. Kinésithérapie, La Revue, 18(195), 10–22.). Récemment, il a pris la décision de participer à l’évolution des pratiques en France et a donc fourni ce travail de titan que vous pourrez lire dès la fin de cette trop longue introduction afin de faciliter la pratique clinique des kinésithérapeutes. Bonne lecture.
Aide à la relecture et remerciements à : Anthony Halimi, Gaëtan Henry, Joshua Lavallée, Francis Grondin, Laurent Fabre
Dans cet article, vous trouverez un travail de revue de la littérature sans revue systématique, afin de mettre en avant les tests cliniques les plus pertinents, aidant au diagnostic de neuropathies.
Les tests neurologiques ne servent pas tous à évaluer la même structure et ne sont pas dans les mêmes domaines d’évaluation de la fonction nerveuse (Coppieters 2016 (1)). Cette information est cruciale car elle permet d’avoir un avis plus éclairé et critique sur les études diagnostiques. L’imagerie analyse la structure, l’ENMG la fonction de certaines fibres, les tests de « mise en tension » leur seuil d’adaptation aux contraintes (ou mécanosensibilité) … Il n’existe pas de gold standard parfait pour ce type d’atteinte au vu de la diversité du type de fibres atteintes. Cependant, combiner tous les tests permettant d’évaluer la fonction des différentes fibres, serait une bonne solution pour faire office de référence standard.
En neurosciences, une neuropathie ou La neuropathie périphérique est une maladie des nerfs périphériques externes au cerveau et à la moelle épinière, y compris les maladies des racines nerveuses, des ganglions, du plexus, des nerfs autonomes, des nerfs sensoriels et des nerfs moteurs (https://meshb.nlm.nih.gov/record/ui?ui=D010523)
Une radiculopathie est définie comme une maladie d’une seule racine nerveuse spinale. C’est une sous-catégorie des neuropathies. (https://meshb.nlm.nih.gov/record/ui?ui=D011843)
Une compression nerveuse est définie comme la manifestation d’une Compression mécanique des nerfs ou des racines nerveuses de causes internes ou externes. Celles-ci peuvent entraîner un blocage de la conduction des impulsions nerveuses ou une perte axonale. Les lésions du nerf et de la gaine nerveuse peuvent être causées par l’ischémie, l’inflammation ou un effet mécanique direct. (https://meshb.nlm.nih.gov/record/ui?ui=D009408)
Selon l’IASP (international association for study of pain), la douleur neuropathique est la douleur causée par une lésion ou une maladie du système nerveux somatosensoriel.(https://www.iasp-pain.org/GlobalYear/NeuropathicPain)
Il existe un spectre de variation d’état irradiant allant d’une douleur neuropathique sans dommage du nerf et inversement, en passant par une douleur nociceptive avec déficit neurologique ou non.
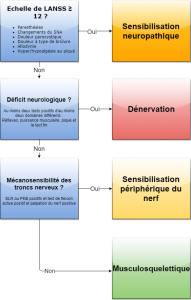
Il existe une classification proposée par Schäfer et al 2011 (2). Cette classification est aujourd’hui incomplète car :
- Elle nécessite de compléter les tests neurologiques par l’évaluation des petites fibres nerveuses, et d’autres éléments que nous allons développer tout le long de ce travail ;
- Bien qu’elle propose une classification entre les signes de dénervation (neuropathie/radiculopathie), les signes de mécanosensibilité, les signes d’atteinte neuropathique et les douleurs nociceptives, elle ne propose pas de combinaison mixte (un patient avec une radiculopathie peut présenter des signes de mécanosensibilité).
Malgré un historique en faveur de douleur neuropathique, il arrive qu’elle soit difficile à objectiver à l’examen clinique. Quels tests nous permettraient de les identifier et comment les interpréter ?
Pour répondre à ces questions, il faut savoir lorsqu’on évoque un test : « Que teste-t-il vraiment ?» et « Avec quelle précision ? »
Que testons-nous vraiment ?
Un nerf est composé de différentes familles de fibres nerveuses ne véhiculant pas la même information et n’ayant pas la même fonction. Il semble pertinent d’évaluer l’ensemble de ces différentes fibres. Nous allons exposer les tests permettant d’évaluer des différentes fibres nerveuses.
Avec quelle précision ?
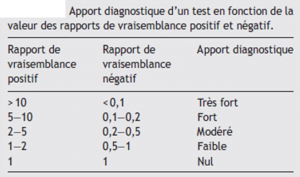
Une multitude de tests existent, cependant la plupart ont montré qu’ils n’étaient pas fiables (difficilement reproductibles) ou peu valides, c’est-à-dire un trop grand écart entre la valeur mesurée et la valeur comparée à un test de référence le plus pertinent. Parfois le test peut même ne pas mesurer ce qu’il est censé mesurer. (Piette 2016 (3), Christe 2017 (4)) En clinique seuls les ratios de vraisemblance sont utiles car nous ne savons pas si le patient est atteint ou non, contrairement à la sensibilité et la spécificité où nous connaissons l’état du malade. Les ratios de vraisemblance expriment la probabilité d’avoir un test positif chez les malades et la probabilité d’avoir un test négatif chez les non malades.
Un « bon » test diagnostique permet d’influencer les probabilités d’être en présence d’un certain diagnostic. Donc plus la valeur du RV s’écarte de 1 plus le test apporte des informations intéressantes.
Rapport de vraisemblance positif
Le rapport de vraisemblance positif (RV(+)) est le rapport entre la probabilité de présenter un test positif quand la personne est malade et la probabilité de présenter un test positif quand la personne n’est pas malade.
Rapport de vraisemblance négatif
Le rapport de vraisemblance négatif (RV(-)) est le rapport entre la probabilité de présenter un test négatif quand la personne est malade et la probabilité de présenter un test négatif quand la personne n’est pas malade.
Petit rappel physiopathologique : la compression nerveuse.
Lors de compressions nerveuses modérées, il a été mis en évidence une altération des fibres myélinisées et des fibres non myélinisées. Lorsqu’un nerf est soumis à des compressions, étirements, frictions importantes ou répétées, il se produit une augmentation de la perméabilité des vaisseaux sanguins extraneuraux avec formation d’un œdème. Si la situation persiste, ou lors d’un traumatisme important, l’œdème envahit l’espace intraneural et crée une fibrose. Le nerf devient adhérent, au détriment de sa capacité d’allongement et de glissement entre les structures voisines. (Schmid et al 2013 (5))
Cependant pour les fibres myélinisées c’est majoritairement la gaine de myéline qui était altérée et non la fibre nerveuse en elle-même, contrairement aux fibres non myélinisées qui dégénèrent et se dégradent plus vite. Ce qui fait que l’on peut se retrouver avec des neuropathies montrant de faibles atteintes des fibres motrices myélinisées, mais des atteintes sensitives plus importantes.
Ce modèle observé chez le rat est également observé chez l’humain lors d’atteinte comme le syndrome du canal carpien. (Schmid et al 2013 (5)) L’examen clé qui a permis de mettre en évidence cette différence est la biopsie de peau. En effet la biopsie nous permet d’observer la population de fibres présentes.
Les patients étant atteint d’un Syndrome du canal carpien montrait une population de fibres de petits calibres (non myélinisées ou très faiblement) beaucoup moins importante. Cette observation semblait totalement indépendante de l’ENMG. Il semblerait donc que l’ENMG ne soit pas le test de référence aidant au diagnostique de toutes les neuropathies. Un ENMG normal ne permet donc pas d’exclure une neuropathie. Mais un test positif permet d’aider au diagnostic de neuropathie, car l’ENMG traduit la fonction uniquement des fibres nerveuses myélinisées. Il n’évalue pas toutes les fibres nerveuses qui sont atteintes de manière inégale lors de neuropathies.
Lors d’atteintes du système neural nous pouvons retrouver plusieurs schémas cliniques. Les douleurs neuropathiques, les douleurs liées à une mécanosensibilité nerveuse, les déficits neurologiques les douleurs liées à un excès de nociception… (Schmid et al 2014 (6))
Pour chacun des tests présentés, leurs ratios de vraisemblances sont associés afin de comprendre leur apport diagnostique ainsi que le test de référence lors de l’étude.
Les premières aides au diagnostic de neuropathies
Certains questionnaires existent afin de discriminer si le patient est atteint de douleurs neuropathiques ou non. Étant donné que le traitement pharmacologique actuel des patients avec et sans composante de douleur neuropathique diffère fortement selon si il y a ou non une NePC (neuropathic pain component), une classification correcte de la douleur des patients est nécessaire. (Dworkin et al 2013 (7)) Il est estimé qu’entre 6.9% et 10% des patients présentant des douleurs, ont une composante neuropathique (NePC ou neuropathic pain component). (van Hecke et al 2014 (8))
Un questionnaire français : le DN4
Vous pouvez le télécharger ici
Afin de pouvoir estimer la probabilité d’une douleur neuropathique, le patient doit répondre à chaque item des 4 questions. Si le score total est supérieur ou égale à 4/10 alors nous retrouvons ces ratios de vraisemblance RV+ 4.5 / RV- 0.24. Ce questionnaire est même meilleur dans l’aide diagnostic chez une population diabétique RV+ 9,6/RV-0.22 (Bouhassira et al 2005 (9), Padua et al 2013 (10), Spallone et al 2012 (11))
Le test de référence était le classement de patients atteints de neuropathies par des cliniciens experts, indépendants « Neuropathic Pain Special Interest Group (NeuPSIG) of the International Association for the Study of Pain (IASP) »
Pour ce qui est du diagnostic de radiculopathie, le DN4 montre ces ratios de vraisemblance RV+ 1,32/ RV -0,56 , avec le même test de référence (Epping et al 2017 (12)).
Le DN4 est donc un questionnaire utile afin de dépister des douleurs neuropathiques et non des radiculopathies
Les autres questionnaires
D’autres questionnaires tout aussi valides et fiables existent, le LANSS (N’a pas été validé en français), le painDETECT (N’a pas été validé en français), le ID Pain (N’a pas été validé en français) et ont tous une bonne validité discriminante pour dépister la présence de NePC chez les patients atteints de lombalgies chroniques. Malgré l’utilisation de tous les tests, 20 à 30 % des patients ayant un NePC n’ont pas pu être classés comme ayant une composante neuropathique par la seule utilisation de ces tests, ce sont donc 20 à 30% de faux négatifs. De faux positifs apparaissent également lors d’atteintes douloureuses chroniques, en effet, l’article de Spahr et al 2017 (13) a montré que le painDetect est positif chez des gens n’ayant pas d’atteinte neuropathique.
Ainsi, ces questionnaires ne peuvent être utilisés qu’à titre d’indice initial dans le dépistage des NePC, mais ne remplacent pas le jugement clinique. (Gudala et al 2017 (14))
Les myélopathies
Les myélopathies désignent les pathologies caractérisées par une compression de la moelle épinière. Nous pouvons les considérer comme une atteinte du système nerveux. Il est donc essentiel de savoir les diagnostiquer.
Un questionnaire pour exclure les myélopathies ?
Un test a été mis en place aussi afin de faire l’Exclusion de myélopathie cervicale. Ce test s’appelle le Japanese Orthopaedic Association Cervical Myelopathy Evaluation Questionnaire (JOACMEQ) que vous pouvez trouver ici mais qui n’a pas été validé en français (Kobayashi et al 2011 (15)) .
Le seuil de positivité a été défini comme : 6/13, parce que la somme des sensibilités était suffisante pour le dépistage. Nous retrouvons des ratios de vraisemblance RV+ 2,86 / RV- 0.096 (Mizer et al 2017 (16)) Ce test est donc surtout utile afin d’exclure une Myélopathie Cervicale. Le test de référence était la classification de patients par éléments cliniques et radiologiques (IRM).
Une classification faite uniquement par IRM n’est pas valable seule, étant donnée que la prévalence de signes radiologiques « non normaux » dans une population saine est quasi identique à une population symptomatique (Cao et al 2017 (17), Brinjiki et al 2015 (18)) l’imagerie est toujours à recouper avec la clinique.
Un cluster afin d’identifier des myélopathies cervicales
Le cluster de Chad Cook lie tests et signes cliniques subjectifs du patient. En effet certaines données combinées peuvent orienter de manière plus précises vers le diagnostic de myélopathie, ou l’exclusion de ce diagnostic.
Une combinaison de 5 critères améliorait fortement les chances d’inclure ou d’exclure une myélopathie cervicale. Avec d’autres termes, d’augmenter la probabilité post test d’être atteint du trouble, ou la diminuer : RV+ 30,1 si 3 tests ou plus sont positifs et RV- 0.18 si un seul des critères est positif. Les critères sont : une instabilité à la marche, un test de Hoffmann positif, un signe du supinateur inversé, un test de Babinski positif et avoir plus de 45 ans (Cook et al 2011 (19), Mizer 2017 (16)) Le test de référence était un classement des patients par des cliniciens experts (pareil au NeuPSIG) avec confirmation par IRM si besoin.
Il faut tout de même savoir qu’une myélopathie cervicale peut-être symptomatique ou non. Nous pouvons retrouver des réflexes neurologiques positifs aux tests chez des patients ne souffrant pas (n’ayant aucune plainte particulière) et chez qui nous trouvons une IRM montrant une compression médullaire / myélopathie. (Mizer et al 2017 (16)) Nous avons donc des dissociations radio/cliniques. Les thérapeutes doivent donc se méfier des faux positifs ainsi que des faux négatifs liés à l’imagerie.
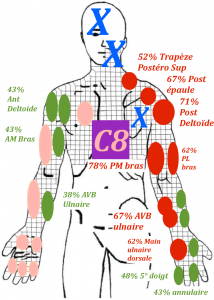
L’évaluation des dermatomes
Un dermatome est non spécifique d’une racine nerveuse (Murphy et al 2009 (20), Petersen et al 2017 (21), Schmid et al 2018 (22))
L’évaluation d’un dermatome ainsi que la positivité de troubles neurologiques sensitifs, ne permet pas de faire de prédiction sur l’étage incriminé. Cela pourrait expliquer la faible valeur prédictive de l’évaluation des dermatomes dû en partie aux anastomoses nerveuses et particulièrement à une neuro-inflammation immune (Murphy et al 2009 (20), Petersen et al 2017 (21), Schmidt et al 2018 (22)) Cette dernière intervient à la suite de compressions neurales chroniques et est retrouvé à la base des ganglions rachidiens du nerf comprimé, mais également à distance de ce dernier. (Ellis et al 2013 (23))
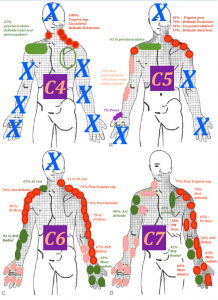
En effet chez les patients atteints d’une neuropathie compressive, donc localisée à une racine nerveuse ou une branche nerveuse, on observe une distribution des symptômes qui ne respecte pas le dermatome (Murphy et al 2009 (20)). Dans l’ensemble, lors d’une atteinte radiculaire cervicale douloureuse,la douleur ne suivait pas les dermatomes chez plus des deux tiers des patients (69,7 %). Pour les atteintes radiculaires lombaires, la douleur ne suivait pas les dermatomes dans un peu moins des deux tiers (64,1 %) des cas. En résumé, les symptômes qui ne suivent pas un dermatome précis, n’excluent pas une neuropathie. Des symptômes en dehors des dermatomes classiques sont retrouvés chez la plupart des patients ayant des atteintes cervicales ou lombaires. (Slipman et al 1998 (24), Furman et al 2018 (25))
Traduction par Laurent Fabre des cartographies des douleurs provoquées aux racines nerveuses ; tirée de l’étude de Slipman et al 1998 (24)
En conclusion, nous ne pouvons pas nous servir de l’étude des dermatomes afin de mettre en évidence la racine nerveuse atteinte.
Cependant il reste intéressant de tester plusieurs dermatomes afin de faire état des troubles neurologiques du patient et de suivre leur évolution. Cela permet d’apprécier aussi l’étendue de l’atteinte, sa sévérité.
L’évaluation des grosses fibres et des fibres myélinisées.
Nous commençons donc par l’évaluation des fibres myélinisées ainsi que les grosses fibres (Aα ou Aβ) La fonction de ces fibres est représentée majoritairement par la discrimination tactile, la motricité ainsi que les réflexes.
L’électroneuromyogramme ou ENMG
L’ENMG évalue la neurophysiologie des fibres nerveuses myélinisées à travers l’amplitude de la réponse nerveuse à un stimulus, la vitesse de conduction motrice ou sensitive de cette stimulation Les ratios de vraisemblance sont : RV+ 2,655 / RV- 0.324 (Narayanaswami et al 2015 (26))
Cependant la précision diagnostique est plus faible lors d’atteinte radiculaire modérée que sévère. Sen = 0.4 quand modéré Sen = 0.8 quand l’atteinte est sévère. Le test de référence était la clinique du patient qui présentait au moins 2 signes d’atteinte des fonctions neurologiques.
L’ENMG ne permet pas non plus de détecter le site de lésion nerveuse (Feinberg et al 2006 (27)).
Le Testing Manuel
Ce testing permet l’évaluation de la fonction des fibres motrices à travers la contraction musculaire. Il existe différentes causes pouvant provoquer une altération de la contraction (douleurs, myopathie, radiculopathie, SLA…)
Le testing ne permet pas d’aider à émettre un diagnostic sur la cause de cette perte de fonction, cependant c’est un outil intéressant qui permet d’évaluer l’évolution de l’état fonctionnel du patient au fil des séances. Il est donc recommandé d’effectuer ce test si une neuropathie semble être présente, afin de pouvoir faire état d’une dégradation des symptômes du patient.
Cependant, le testing manuel n’étant pas assez précis afin de mettre en avant une atteinte ou d’en faire le suivi, un dynamomètre est recommandé (Pfister et al 2018(28)). De plus il faudrait une différence d’au moins 20% de force avec les muscles controlatéraux, afin de pouvoir noter une différence cliniquement perceptible à main nue. Ce fut évalué sur des épaules montrant des lésions labrales (Nagatomi et al 2018 (29)).
Les réflexes ostéo-tendineux
L’évaluation des reflexes ostéo-tendineux et des reflexes cutanés montrent une utilité diagnostique lors d’atteinte neurologiques. Cependant un test de réflexe négatif ne permet pas d’exclure de neuropathie. Un test positif augmente la probabilité d’être atteint de neuropathie. La positivité d’un test de réflexe est décrit comme : une abolition du reflexe, une exagération du réflexe, un clonus, ou une diminution significative comparativement au côté sain. La précision diagnostic des réflexes semble utile lorsqu’elle est dans un ensemble précis de données cliniques ou dans l’utilisation d’un cluster. Par exemple il a été mis en évidence que « l’examen réflexe de la cheville combiné à un test sensoriel par vibration ou par piqûre d’épingle (pinpcrick) est la combinaison la plus sensible pour le diagnostic de la polyneuropathie, et devrait être considéré comme une composante essentielle minimale de l’examen physique chez les patients soupçonnés de polyneuropathie » (Cook et Hegedus 2013 (30), Abraham et al 2017 (31), Tawa et al 2017 (32), Petersen et al 2017 (21))
La pallesthésie.
L’évaluation de la sensibilité vibratoire est habituellement mesuré par diapason de 64Hz (Rydell Seiffer) ou de 128Hz.
Les ratios de vraisemblance sont : RV+ 2,07 / RV- 0.8 lorsque le test de référence est une analyse de conduction nerveuse par ENMG (Lai et al 2014 (33)).
Il semblerait que plus l’atteinte neurologique est sévère et altérant plusieurs fonctions, plus la spécificité du test augmente. La positivité du test est décrite comme la diminution de la capacité de signaler quand la vibration a été appliquée et quand la vibration s’est atténuée alors qu’elle était encore appliquée. Ce test clinique a majoritairement été étudié sur une population diabétique atteinte de polyneuropathies (Pestronk et al 2004 (34)). Ce qui doit fait que nous devons prendre ces résultats avec précautions car la population choisie n’est pas forcément représentative de celle que l’on peut retrouver en cabinet.
Kinesthésie et proprioception
L’un des défis de l’examen de la kinesthésie est la reproductibilité du test (Han et al 2016 (35)). En effet, il faudrait une homogénéisation des pratiques dans l’évaluation clinimétrique de ces tests. Pourtant quelques données viennent, malgré tout, montrer un intérêt clinique à cette évaluation. Ces tests ont montré une utilité au diagnostic de neuropathies du membre inférieur. Nous retrouvons pour l’évaluation de la kinesthésie du gros orteil ces ratios de vraisemblance : RV+ 2.83 / RV- 0.17. Pour l’évaluation de la kinesthésie de la cheville ils sont de : RV+ 25 / RV- 0.76. La positivité du test est décrite comme l’impossibilité du patient à répondre correctement 8 fois sur 10 lorsque le thérapeute test le patient. Le test de référence était un ensemble entre l’examen clinique et un examen électrodiagnostic (Richardson et al 2002 (36)).
La sensibilité mécanique et tactile
La sensibilité tactile mécanique, est mesurée en partie en produisant des pressions graduelles avec des monofilaments en plastique « von Frey hairs » .La positivité du test est décrite comme l’incapacité de ressentir la stimulation qui est appliquée au patient. Les ratios de vraisemblance sont de RV+ 4.56 / RV- 0.53. Le test de référence est une étude de la conductivité nerveuse. Ce test est utile afin de faire le diagnostic de neuropathies (Wang et al 2017 (37)). Ce test semble utile dans l’aide au diagnostic de neuropathies.
Concernant la sensibilité tactile du toucher fin ou « light touch » il y a actuellement une remise en question sur comment effectuer et interpréter ce test. En effet il est fastidieux et long de proposer au patient un examen complet de ses dermatomes étant donnée la faible validité diagnostique de l ‘évaluation de ces derniers. Il semblerait que l’évaluation des grosses fibres soit meilleure pour l’aide au diagnostic de neuropathie. Le « light touch » serait utile en complément afin d’évaluer si il y a une perte totale ou partielle de cette sensibilité, ou si une allodynie est présente.
(Fuller 2016 (38), Mücke et al 2016 (39))
La boule de coton est utilisé majoritairement car c’est l’un des élément qui stimule la sensibilité tactile légère avec le moins de force possible (2-4 mN) Un pinceau pourrait également faire l’affaire (200-400 mN) (Mücke et al 2016 (39)). Certains experts mondiaux comme Annina Schmid recommandent également l’utilisation d’un mouchoir.
L’évaluation des petites fibres et des fibres non myélinisées
Les fibres non myélinisée et fibres peu myélinisées de petits calibres (fibres Aδ et C).
L’évaluation des fibres non myélinisées a longtemps été négligée depuis la découverte de l’ENMG. En effet nous pensions depuis longtemps à tort que l’ENMG évaluait la fonction de toutes les fibres nerveuses alors qu’elle n’évalue que celle des fibres myélinisées de gros calibre, en excluant les autres fibres. Les fonctions de ces fibres sont représentées majoritairement pas la sensibilité thermique et la nociception.
Il reste bon à noter qu’il n’existe pas de fibres dédiées à la douleur. En effet cette condition clinique présentée comme : « une expérience sensorielle et émotionnelle désagréable, associée à une lésion tissulaire réelle ou potentielle, ou décrite dans ces termes » (IASP) La nociception n’est qu’une composante nécessaire ou non, à la création de douleur, parmi la multitude d’éléments ayant une importance dans la perception de la douleur.
Au fil des années s’est posé la question des meilleurs tests pouvant évaluer les fibres négligées par l’examen neurologique. La biopsie de la peau a été la réponse adéquate et est désormais le test de référence dans le diagnostic de neuropathie des petites fibres nerveuses. (Sommer et al 2007 (40), Lauria et al 2007 (41), Hovaguimian et al 2011 (42), Terkelsen et al 2017 (43), Schmid et al 2015 (44))
La nociception
La première fonction que nous pouvons évaluer est la nociception grâce au « pinprick » ou neurotip. Les ratios de vraisemblance sont de : RV+ 13.5/ RV- 0.5 La positivité du test est défini comme une diminution des sensations dans la reconnaissance du stimuli comparativement au côté sain. Le test de référence était une biopsie de peau. (Ridelhagh et al 2017 (45)) Ce test est très utile dans l’aide au diagnostic et l’inclusion de neuropathie, ici du syndrome du canal carpien.
La sensibilité thermique
La seconde est le seuil de détection de chaleur « warm detection threshold ». Les ratios de vraisemblance sont de RV+ 5.93 / RV- 0.13. La positivité du test est définie comme l’incapacité ou la difficulté du patient à détecter des changements de température plus élevées que la température de sa peau, comparativement au côté sain.
Des pièces métalliques identiques conservées à des températures différentes peuvent être utilisées, ou le Tip therm (Appareil coûtant une vingtaine d’euros). Le test de référence était une biopsie de peau. (Ridelhagh et al 2017 (45)) Ce test est très utile dans l’aide au diagnostic de neuropathie, ici du syndrome du canal carpien.
La dernière est la douleur liée au froid « cold sensation / cold pain perception ». La positivité du test est décrite comme une douleur présente lors de la stimulation par un objet froid. Une pièce de monnaie ou le manche du diapason peut faire l’affaire. RV+ ∞/ RV- 0.91. Le test de référence était une biopsie de peau. (Ridelhagh et al 2017 (45)) Ce test est très utile dans l’aide au diagnostic et l’inclusion de neuropathie, ici du syndrome du canal carpien. Un test négatif ne nous donne aucune information utile.
Les tests neurodynamiques
Une dernière famille de tests existe et n’évalue pas la fonction des fibres nerveuses comme les tests cités précédemment. Ce sont les tests de provocation neurale, qui évaluent la « mécanosensibilité neurale ». Ils sont parfois appelés tests de mise en tension neurale ou tests neurodynamiques. Ces tests n’évaluent pas la mobilité du nerf comme il a souvent été colporté.
Cependant les douleurs liées à une « mécanosensibilité neurale» ne sont pas classées comme douleurs neuropathiques, car il a été mis en évidence par plusieurs études des douleurs liées à la mécanosensibilité neurale sans lésion nerveuse. (Schmid et al 2018 (22))
Elles sont classées comme des douleurs nociceptives. Il n’y a pas de perte de fonction lorsqu’une mécanosensibilité neurale est élevée. ( Il peut bien sûr y avoir des atteintes mixtes )
Il a été mis en évidence par plusieurs études des douleurs liées à la mécanosensibilité neurale sans lésion nerveuse mais par le déclenchement d’inflammation qui peut parfois entretenir un schéma douloureux (Schmid et al 2018 (22), Dilley et al 2005 (48), Greening et al 2011 (47)) L’inflammation peut toucher les fibres C à l’intérieur du nerf, ou le nervi nervorum à l’extérieur du nerf (Dilley et al 2008 (48))
La positivité d’un test neurodynamique est décrite comme la reproduction des symptômes en position de mise en tension neurale, étant modifié par une manœuvre de différenciation structurelle (flexion de tête ou de cheville par exemple) (Bueno Gracia et al 2016 (49)), Schmid et al 2018 (22), Coppieters 2016 (1)).
Il a été également mis en évidence que ce sont de bons tests qui permettent d’augmenter la probabilité post-test d’être atteint par une neuropathie lorsque le test est positif. Mais ils ne sont pas assez précis pour en diminuer la probabilité post-test lorsque le test est négatif. En effet, les patients atteints d’un syndrome du canal carpien qui présentaient des ULNT négatifs montraient également une perte plus prononcée des fonctions liées au seuil de détection de température thermique, au seuil de détection des vibrations. (Baselgia 2017 (50))
Il semble donc intéressant de se servir de la clinique et de l’historique du patient afin d’interpréter ces tests. Le pronostic ne sera sûrement pas le même selon le stade d’atteinte du patient. Il semble, au vu des données, qu’un patient ayant une atteinte plus ancienne et plus prononcée des fibres nerveuses, accompagnée d’une diminution des fonctions nerveuses, montre un test de mise en tension nerveuse négatif.
Tests neurodynamiques du membre supérieur (Upper Limb Neural Tension Test)
L’ULNT montre ces ratios de vraisemblance pour l’aide au diagnostique du syndrome du canal carpien RV+ 3,67 / RV- 0.5 (Bueno Gracia 2016 (49)) Il faut prendre cette clinimétrie avec précaution car le test de référence pris pour cette étude est l’ENMG.
Pour l’aide au diagnostic de radiculopathies du membre supérieur nous retrouvons des ratios de RV+ 3,13 / RV- 0.04 (Thoomes 2018 (51)). Ce n’est qu’une aide au diagnostic, mais pour évaluer une neuropathies les autres tests cités dans ce billet permettent ce que ne peut pas faire le test Neurodynamique.
Comme expliqué plus haut, l’ENMG permet d’évaluer la fonction des grosses fibres myélinisées alors que la mécanosensibilité, les fibres de petits calibres non myélinisées. L’ULNT est donc un excellent test permettant d’exclure une radiculopathie et est plus modéré dans l’aide au diagnostic d’un syndrome du canal carpien.
Tests neurodynamiques du membre inférieur
SLUMP vs SLR (straight leg raise) : La différence entre ces deux tests est que le premier est en charge et non le second. Ce qui fait que l’on pourrait re-créer les conflits disco-radiculaires plus facilement avec le SLUMP qu’avec le SLR. L’IRM se faisant généralement en décubitus dorsal, ne sont donc pas recréés les potentiels conflits. Un grand nombre de faux positifs peut donc s’expliquer pour le SLUMP lors des études diagnostics. Ces deux tests ont souvent été utilisés dans la littérature afin de pouvoir déterminer s’ils aident au diagnostic de radiculopathies ou de hernies discales. Or nous avons vu précédemment que ces tests peuvent surtout nous orienter afin de savoir si une mécanosensibilité est présente et est symptomatique. Ces deux tests montrent des résultats contradictoires dans le diagnostic de hernies discales et de radiculopathies. Il semblerait qu’ils ne soient pas utiles dans l’aide au diagnostic de compressions foraminales ou de hernie discales (Ekedhal et al 2018 (52)) mais ils sont utiles dans l’exclusion de la présence de compression de racine nerveuse sous-articulaire. (SLUMP : RV- 0.01 et SLR : RV- 0.13) Le test de référence était l’imagerie par IRM. La compression nerveuse était de haut grade chez des patients chroniques. Ces tests ne sont pas utiles au diagnostic de compression nerveuse lorsqu’elle était de faible grade.
Le SLUMP est plus utile dans l’exclusion de douleurs neuropathiques : RV+ 3,03 / RV- 0,13. Le test référence était une classification des experts à l’aide des différents tests neurologiques (Quantative Sensory Testing + muscle weakness + SLR) (Urban et al 2015 (53)) Le SLUMP n’est pas utile dans l’aide au diagnostic de hernies discales (Edekhal et al 2018 (52)) RV+ 1,22 / RV- 0,61.
Le SLR utilisé seul n’aide pas au diagnostic de compression discale (Petersen 2016 (21)) Cependant, Le SLR homolatéral étant très sensible et le cross SLR étant très spécifique une utilisation de ces deux tests pourrait être intéressante afin de déterminer si une compression discale symptomatique existe. De nouvelles études menées sur ce modèle pourraient nous apporter des éléments de preuves en faveur ou non de cette hypothèse.
Tous les tests utilisés seuls sont peu intéressants en clinique (Hancock 2011 (54)) et ne sont pas utiles afin d’aider au diagnostique d’une hernie discale. Une utilisation aléatoire des tests ne permet pas non plus d’aider au diagnostic.
Un dernier pour la route ?
Ces tests sont d’excellents tests aidant au diagnostic d’atteinte des petites fibres nerveuses.
Nous pouvons évoquer le phénomène de « wind-up ». Qui se produit lors d’une stimulation répétée à fréquence de 1Hz avec le pinprick à un point précis. La sommation temporelle étant plus élevée pour les fibres C, les patients ayant une atteinte des fibres de petits calibres deviennent douloureux après plusieurs stimulations (Mücke et al 2016 (39))
Éléments cliniques importants
Certains facteurs augmentent les chances de développer des neuropathies, comme le diabète, les troubles thyroïdiens, l’amyloïdose, une carence en vitamine B12, l’alcoolisme, le VIH, le syndrome de Guillain barré… Tous ces éléments sont à prendre en considération lors de l’interrogatoire car la neuropathie peut se trouver être la conséquence de certains troubles plus grave.
Shy ME. Peripheral neuropathies. In: Goldman L, Schafer AI, eds. Goldman’s Cecil Medicine. 25th ed. Philadelphia, PA: Elsevier Saunders; 2016:chap 420 (55).
Conclusion
Il reste important de signaler que les différentes douleurs sont le plus souvent mixtes ainsi que des fibres nerveuses de différents types sont majoritairement atteintes sans distinction. De plus, nous pouvons retrouver une radiculopathie associée à une sensibilisation centrale ou une sensibilisation périphérique. La majorité des tests cliniques ne sont pas assez bons pour nous aider à exclure une neuropathie. C’est pour cette raison que les questionnaires adaptés, la multiplicité des tests et l’analyse des facteurs psycho-sociaux sont à coupler afin d’émettre un diagnostic le plus précis possible, qui orientera le traitement à suivre.
L’intérêt d’un examen clinique rigoureux est d’avoir une idée du pronostic du patient, tout en faisant état au début de rééducation de ses fonctions neurales afin de noter les évolutions. Nous pouvons également orienter le patient vers un traitement le plus efficace possible selon le sous-groupe de patient auquel il appartient.
(Mücke et al 2016 (39), La Cesa et al 2016 (56), Neblett et al 2017 (57), Karayannis et al 2012 (58))
BIBLIOGRAPHIE PAR ORDRE DE PASSAGE
- Michel Coppieters. Validity of neurodynamics tests. Congrès IFOMPT 4-8 Juillet 2016 . Glasgow, Ecosse. 6 Juillet 2016
- SCHÄFER, A., HALL, T., MÜLLER, G., & BRIFFA, K. (2011). Outcomes differ between subgroups of patients with low back and leg pain following neural manual therapy: a prospective cohort study. European Spine Journal, 20(3), 482–490.
- PIETTE, P. Métrologie appliquée à la kinésithérapie: mesures, tests et bilans, concepts fondamentaux. In : EMC. 2016.
- CHRISTE, G. (2017). Validité d’un test diagnostique : utilité clinique de la sensibilité, spécificité et rapports de vraisemblance. Mains Libres. Janvier 2017. P 47-52
- SCHMID, Annina B., NEE, Robert J., et COPPIETERS, Michel W. Reappraising entrapment neuropathies–mechanisms, diagnosis and management. Manual therapy, 2013, vol. 18, no 6, p. 449-457.
- SCHMID, Annina B., BLAND, Jeremy DP, BHAT, Manzoor A., et al. The relationship of nerve fibre pathology to sensory function in entrapment neuropathy. Brain, 2014, vol. 137, no 12, p. 3186-3199.
- R.H. Dworkin, A.B. O’Connor, J. Kent, S.C. Mackey, S.N. Raja, B.R. Stacey, R.M. Levy, Backonja, R. Baron, H. Harke, J.D. Loeser, R-D. Treede, D.C. Turk, C.D. Wells, Interventional management ofneuropathic pain: NeuPSIG recommendations, PAIN (2013)
- VAN HECKE, O., AUSTIN, Sophie K., KHAN, Rafi A., et al.Neuropathic pain in the general population: a systematic review of epidemiological studies. PAIN®, 2014, vol. 155, no 4, p. 654-662.
- BOUHASSIRA, Didier, ATTAL, Nadine, ALCHAAR, Haiel, et al.Comparison of pain syndromes associated with nervous or somatic lesions and development of a new neuropathic pain diagnostic questionnaire (DN4). Pain, 2005, vol. 114, no 1-2, p. 29-36.
- PADUA, Luca, BRIANI, C., TRUINI, A., et al. Consistence and discrepancy of neuropathic pain screening tools DN4 and ID-Pain. Neurological Sciences, 2013, vol. 34, no 3, p. 373-377.
- SPALLONE, V., MORGANTI, R., D’AMATO, C., et al. Validation of DN4 as a screening tool for neuropathic pain in painful diabetic polyneuropathy. Diabetic Medicine, 2012, vol. 29, no 5, p. 578-585.
- EPPING, R., VERHAGEN, Arianne P., HOEBINK, E. A., et al.The diagnostic accuracy and test-retest reliability of the Dutch PainDETECT and the DN4 screening tools for neuropathic pain in patients with suspected cervical or lumbar radiculopathy. Musculoskeletal Science and Practice, 2017, vol. 30, p. 72-79.
- SPAHR, N., HODKINSON, D., JOLLY, K., et al. Distinguishing between nociceptive and neuropathic components in chronic low back pain using behavioural evaluation and sensory examination. Musculoskeletal Science and Practice, 2017, vol. 27, p. 40-48.
- GUDALA, Kapil, GHAI, Babita, et BANSAL, Dipika. Usefulness of four commonly used neuropathic pain screening questionnaires in patients with chronic low back pain: a cross-sectional study. The Korean journal of pain, 2017, vol. 30, no 1, p. 51-58.
- KOBAYASHI, Hiroshi, KIKUCHI, Shin-ichi, OTANI, Koji, et al.Development of a self-administered questionnaire to screen patients for cervical myelopathy. BMC musculoskeletal disorders, 2010, vol. 11, no 1, p. 268.
- MIZER, Adam, BACHMANN, Alexa, GIBSON, Jessie, et al. Self-report and subjective history in the diagnosis of painful neck conditions: A systematic review of diagnostic accuracy studies. Musculoskeletal Science and Practice, 2017, vol. 31, p. 30-44.
- BRINJIKJI, W., LUETMER, Patrick H., COMSTOCK, Bryan, et al. Systematic literature review of imaging features of spinal degeneration in asymptomatic populations. American Journal of Neuroradiology, 2015, vol. 36, no 4, p. 811-816.
- CAO, Jun Ming, ZHANG, Jing Tao, DA LONG YANG, Yi Peng Yang, et al. Imaging Factors that Distinguish Between Patients with Asymptomatic and Symptomatic Cervical Spondylotic Myelopathy with Mild to Moderate Cervical Spinal Cord Compression. Medical science monitor: international medical journal of experimental and clinical research, 2017, vol. 23, p. 4901.
- COOK, Chad E., WILHELM, Mark, COOK, Amy E., et al. Clinical tests for screening and diagnosis of cervical spine myelopathy: a systematic review. Journal of Manipulative & Physiological Therapeutics, 2011, vol. 34, no 8, p. 539-546.
- MURPHY, Donald R., HURWITZ, Eric L., GERRARD, Jonathan K., et al. Pain patterns and descriptions in patients with radicular pain: Does the pain necessarily follow a specific dermatome?. Chiropractic & Osteopathy, 2009, vol. 17, no 1, p. 9.
- PETERSEN, Tom, LASLETT, Mark, et JUHL, Carsten. Clinical classification in low back pain: best-evidence diagnostic rules based on systematic reviews. BMC musculoskeletal disorders, 2017, vol. 18, no 1, p. 188.
- SCHMID, Annina B., HAILEY, Louise, et TAMPIN, Brigitte. Entrapment Neuropathies: Challenging Common Beliefs With Novel Evidence. journal of orthopaedic & sports physical therapy, 2018, vol. 48, no 2, p. 58-62.
- ELLIS, A. et BENNETT, D. L. H. Neuroinflammation and the generation of neuropathic pain. British journal of anaesthesia, 2013, vol. 111, no 1, p. 26-37.
- SLIPMAN, Curtis W., PLASTARAS, Christopher T., PALMITIER, Randal A., et al. Symptom provocation of fluoroscopically guided cervical nerve root stimulation: are dynatomal maps identical to dermatomal maps?. Spine, 1998, vol. 23, no 20, p. 2235-2242.
- FURMAN, Michael B. et JOHNSON, Stephen C. Induced lumbosacral radicular symptom referral patterns: A descriptive study. The Spine Journal, 2018.
- NARAYANASWAMI, Pushpa, GEISBUSH, Tom, JONES, Lyell, et al. Confirmation Bias and Specificity of Electromyography for Radiculopathy (P3. 164). Neurology, 2015, vol. 84, no 14 Supplement, p. P3. 164.
- FEINBERG, Joseph. EMG: myths and facts. HSS Journal, 2006, vol. 2, no 1, p. 19-21.
- PFISTER, Pierrette Baschung, DE BRUIN, Eling D., STERKELE, Iris, et al. Manual muscle testing and hand-held dynamometry in people with inflammatory myopathy: An intra-and interrater reliability and validity study. PloS one, 2018, vol. 13, no 3, p. e0194531.
- NAGATOMI, Takayuki, MAE, Tatsuo, NAGAFUCHI, Teruyoshi, et al. Shoulder manual muscle resistance test cannot fully detect muscle weakness. Knee Surgery, Sports Traumatology, Arthroscopy, 2017, vol. 25, no 7, p. 2081-2088.
- COOK, Chad et HEGEDUS, Eric J. Orthopedic physical examination tests: an evidence-based approach. 2e Ed 2013.
- ABRAHAM, Alon, ALABDALI, Majed, ALSULAIMAN, Abdulla, et al. The sensitivity and specificity of the neurological examination in polyneuropathy patients with clinical and electrophysiological correlations. PloS one, 2017, vol. 12, no 3, p. e0171597.
- TAWA, Nassib, RHODA, Anthea, et DIENER, Ina. Accuracy of clinical neurological examination in diagnosing lumbo-sacral radiculopathy: a systematic literature review. BMC musculoskeletal disorders, 2017, vol. 18, no 1, p. 93.
- LAI, Saien, AHMED, Umair, BOLLINENI, Aruna, et al. Diagnostic Accuracy of Qualitative vs. Quantitative Tuning Forks: Outcome Measure for Neuropathy. Journal of clinical neuromuscular disease, 2014, vol. 15, no 3, p. 96.
- PESTRONK, A., FLORENCE, J., LEVINE, T., et al. Sensory exam with a quantitative tuning fork Rapid, sensitive and predictive of SNAP amplitude. Neurology, 2004, vol. 62, no 3, p. 461-464.
- HAN, Jia, WADDINGTON, Gordon, ADAMS, Roger, et al.Assessing proprioception: a critical review of methods. Journal of Sport and Health Science, 2016, vol. 5, no 1, p. 80-90.
- RICHARDSON, James K. The clinical identification of peripheral neuropathy among older persons. Archives of physical medicine and rehabilitation, 2002, vol. 83, no 11, p. 1553-1558.
- WANG, Fengyi, ZHANG, Jiaqi, YU, Jiadan, et al. Diagnostic Accuracy of Monofilament Tests for Detecting Diabetic Peripheral Neuropathy: A Systematic Review and Meta-Analysis. Journal of diabetes research, 2017, vol. 2017.
- FULLER, Geraint. End the cult of cotton wool. Practical neurology, 2017, vol. 17, no 1, p. 77-78.
- MÜCKE, M., CUHLS, H., RADBRUCH, L., et al. Quantitative sensory testing (QST). English version. Der Schmerz, 2016, p. 1-8.
- SOMMER, Claudia et LAURIA, Giuseppe. Skin biopsy in the management of peripheral neuropathy. The Lancet Neurology, 2007, vol. 6, no 7, p. 632-642.
- LAURIA, Giuseppe et DEVIGILI, Grazia. Skin biopsy as a diagnostic tool in peripheral neuropathy. Nature Reviews Neurology, 2007, vol. 3, no 10, p. 546.
- HOVAGUIMIAN, Alexandra et GIBBONS, Christopher H. Diagnosis and treatment of pain in small-fiber neuropathy. Current pain and headache reports, 2011, vol. 15, no 3, p. 193-200.
- TERKELSEN, Astrid J., KARLSSON, Páll, LAURIA, Giuseppe, et al. The diagnostic challenge of small fibre neuropathy: clinical presentations, evaluations, and causes. The Lancet Neurology, 2017, vol. 16, no 11, p. 934-944.
- Schmid et al 2015, ENTRAPMENT NEUROPATHIES: HAVE SMALL FIBRES BEEN NEGLECTED? , WCPT Congress 2015 / Physiotherapy 2015; Volume 101, Supplement 1 eS1238–eS1642
- RIDEHALGH, C. et SCHMID, A. Validity of small fibre sensory testing. Musculoskeletal Science and Practice, 2017, vol. 28, p. e25.
- DILLEY, Andrew, LYNN, Bruce, et PANG, See Jye. Pressure and stretch mechanosensitivity of peripheral nerve fibres following local inflammation of the nerve trunk. Pain, 2005, vol. 117, no 3, p. 462-472.
- GREENING, Jane et DILLEY, Andrew. Peripheral mechanisms of chronic upper limb pain: nerve dynamics, inflammation and neurophysiology. In : Neck and Arm Pain Syndromes. 2011. p. 476-495.
- DILLEY, Andrew et BOVE, Geoffrey M. Disruption of axoplasmic transport induces mechanical sensitivity in intact rat C‐fibre nociceptor axons. The Journal of physiology, 2008, vol. 586, no 2, p. 593-604.
- BUENO-GRACIA, Elena, TRICÁS-MORENO, José Miguel, FANLO-MAZAS, Pablo, et al. Validity of the Upper Limb Neurodynamic Test 1 for the diagnosis of Carpal Tunnel Syndrome. The role of structural differentiation. Manual therapy, 2016, vol. 22, p. 190-195.
- BASELGIA, Larissa T., BENNETT, David L., SILBIGER, Robert M., et al. Negative Neurodynamic Tests Do Not Exclude Neural Dysfunction in Patients With Entrapment Neuropathies. Archives of physical medicine and rehabilitation, 2017, vol. 98, no 3, p. 480-486.
- THOOMES, Erik J., VAN GEEST, Sarita, VAN DER WINDT, Danielle A., et al. Value of physical tests in diagnosing cervical radiculopathy: a systematic review. The Spine Journal, 2018, vol. 18, no 1, p. 179-189.
- EKEDAHL, Harald, JÖNSSON, Bo, ANNERTZ, Mårten, et al.Accuracy of Clinical Tests in Detecting Disk Herniation and Nerve Root Compression in Subjects With Lumbar Radicular Symptoms. Archives of physical medicine and rehabilitation, 2018, vol. 99, no 4, p. 726-735.
- URBAN, Lawrence M. et MACNEIL, Brian J. Diagnostic accuracy of the slump test for identifying neuropathic pain in the lower limb. journal of orthopaedic & sports physical therapy, 2015, vol. 45, no 8, p. 596-603.
- HANCOCK, Mark J., KOES, Bart, OSTELO, Raymond, et al.Diagnostic accuracy of the clinical examination in identifying the level of herniation in patients with sciatica. Spine, 2011, vol. 36, no 11, p. E712-E719.
- Shy ME. Peripheral neuropathies. In: Goldman L, Schafer AI, eds. Goldman’s Cecil Medicine. 25th ed. Philadelphia, PA: Elsevier Saunders; 2016:chap 420.
- LA CESA, S., TAMBURIN, S., TUGNOLI, V., et al. How to diagnose neuropathic pain? The contribution from clinical examination, pain questionnaires and diagnostic tests. Neurological Sciences, 2015, vol. 36, no 12, p. 2169-2175.
- KARAYANNIS, Nicholas V., JULL, Gwendolen A., et HODGES, Paul W. Physiotherapy movement based classification approaches to low back pain: comparison of subgroups through review and developer/expert survey. BMC musculoskeletal disorders, 2012, vol. 13, no 1, p. 24.
- NEBLETT, Randy, HARTZELL, Meredith M., WILLIAMS, Mark, et al. Use of the Central Sensitization Inventory (CSI) as a treatment outcome measure for patients with chronic spinal pain disorder in a functional restoration program. The Spine Journal, 2017, vol. 17, no 12, p. 1819-1829.

7 Commentaires
bakkar
merci pour cet énorme travail de synthèse et surtout pour le partage!
Mouquet
Super boulot, merci !
Victor Belbéoc'h
Merci pour le boulot!
vizzini jonathan
Mieux vaut tard que jamais=> merci et bravo pour cet énorme taf 😉
Faurie josiane
Bonjour
Je souffre depuis près d’un an de douleurs neuropathiques (bras droit)
Pouvez vous me donner des conseils
Merci d’avance
Carine
Bonjour,
Merci pour votre travail !
Comment fait on pour interpréter le JOACMEQ ?
Merci par avance
Antone
Bonjour! Et merci pour ce travail.
Il est dit que les tests neurodynamiques ne sont pas assez précis pour diminuer la probabilité post-test (lorsque le test est négatif) de présenter une neuropathie. Cependant le RV- est de -0,04 pour exclure une radiculopathie cervicale. Etant donné que la radiculopathie est une neuropathie, on doit considérer cela pour une « exception »?