Aide à la relecture : Marguerite Dontenwille, Robin Vervaeke, Anthony Halimi, Bryan Littré, Théo Chaumeil, Clément Loiseau
Abréviations :
ASI : articulation(s) sacro-iliaque(s)
DSI : douleur(s) en lien avec les articulations sacro-iliaques
SpA : spondylarthrite
vDW : van Der Wurff
CEN : centralisation
P.D. : préférence directionnelle
DDM : douleur(s) discogénique(s) mécanique(s)
Vous trouverez les liens vers les parties 1 et 2 de cette série à la fin de ce billet.
Combinaisons de tests pour les DSI
Nous avons pu voir dans le précédent billet que les indices de l’anamnèse ainsi que la topographie de la douleur ne nous étaient pas d’un grand secours pour ce qui était de différencier une DSI d’une autre affection susceptible de générer des douleurs lombo-pelviennes pouvant irradier dans le(s) membre(s) inférieur(s).
Pour nous aider à y voir plus clair, deux équipes indépendantes dirigées respectivement par Mark Laslett et Peter van der Wurff (vDW) ont isolément proposé une combinaison de tests cliniques, ou clusters.
Leurs clusters respectifs sont très similaires, tant dans le choix des tests que dans leurs résultats en comparaison à la référence standard. Cela a l’avantage de consolider la cohérence externe de ces combinaisons de tests, autrement dit : la confiance que l’on peut avoir dans leur pertinence clinique. Néanmoins, les critères de rigueur méthodologique pour la référence standard n’étaient pas strictement les mêmes [11].
La combinaison de Laslett est constituée des tests de distraction, de compression, de torsion pelvienne (de Gaenslen), du thrust fémoral et du thrust du sacrum [37, 38].
Vous pouvez en retrouver la démonstration ici par Mark Laslett lui-même.
Précautions d’emploi concernant le test en thrust du sacrum :
Avant de réaliser le test en thrust du sacrum, il est nécessaire de palper la crête sacrée afin de s’assurer qu’elle ne soit pas sensible à la palpation (chose possible en cas de lombalgie), ce qui pourrait sinon générer un faux positif lors du test.
De plus, la réponse symptomatique au test en thrust du sacrum doit être comparée à la réponse au test du rebond (spring test) sur les différents étages lombaires : si le test du sacrum reproduit la douleur habituelle du patient, les tests de la colonne lombaire, eux, ne doivent pas reproduire la douleur habituelle, auquel cas on considère le test du sacrum comme positif pour une DSI. Si un ou plusieurs tests lombaires reproduisent la douleur, alors un résultat positif au test du sacrum doit être considéré comme un faux positif pour une DSI et envisager une implication lombaire.
La combinaison de vDW est quant à elle composée des mêmes tests que celui de Laslett à l’exception du thrust du sacrum auquel lui est substitué le test de FABER (flexion – abduction – rotation externe de hanche, de Patrick) dont vous pouvez en retrouver la démonstration ici [39].
Remarques concernant le test de FABER :
Il est à noter que le test de FABER a été décrit pour tester tantôt la hanche, tantôt l’ASI ; son utilité dépend de l’étude, de la population et de la référence standard à laquelle il a été comparée (Figure 9) mais retenons que si c’est l’ASI qui est testée, le critère de positivité est la reproduction d’une douleur postérieure familière au patient, et non d’une douleur antérieure comme ce serait attendu dans le cadre d’une réponse symptomatique de la hanche.

Figure 9 :
Comparaison de la validité diagnostique du test de FABER selon l’étude
(SN : sensibilité, SP : spécificité, RV : ratio de vraisemblance, κ : kappa, CCI : coefficient de corrélation inta-classe)
Remarque doit également être faite que, dans le cas de DSI dans la lombalgie chronique, l’étude de Broadhurst & Bond et l’étude de Dreyfuss et al. présentent des valeurs de précision diagnostique diamétralement opposées. Or, bien que vDW se soit appuyé dessus pour inclure ce test dans son cluster, les résultats de Brodhurst & Bond ne devraient pas être considérés comme valides étant donné que tous les sujets n’ont pas reçu la même référence standard et que la clinimétrie a été mal calculée (la sensibilité était en fait la valeur prédictive positive) [40]. Ainsi, seuls les résultats de Dreyfuss et al. sont recevables (QUADAS = 10, d’après [41]), et ils révèlent l’utilité médiocre de ce test pour diagnostiquer ou exclure une DSI s’il est utilisé seul. Il semble néanmoins reproductible, et son utilité pour le diagnostic de DSI quand il est combiné à d’autres tests a été validée par deux fois [39, 42].
Remarques d’ordre général concernant la réalisation des tests :
Les tests présentés ici ont été évalués dans la population des lombalgies chroniques [37, 39]. Des tests évalués spécifiquement pour les douleurs pelviennes postérieures en lien avec la grossesse existent ; ils seront abordés dans un prochain article.
Ils sont censés tester la mécano-sensibilité des ASI au sens large (surfaces articulaires, capsule, ligaments) sans que l’on puisse ni distinguer entre une étiologie intra ou extra-articulaire ou apprécier la contribution relative de chaque compartiment [1, 18, 20, 43] ni même caractériser la nature de leur affection.
Ces tests sont donc tous des tests de provocation de la douleur : ils sont considérés comme positifs si la douleur habituelle, celle qui motive la consultation, est reproduite clairement. L’inconfort pouvant être ressenti par les prises ne rentre pas en compte dans les critères de positivité de ces tests ; le patient doit en être informé de façon à savoir quelle réponse donner lors de l’exécution des tests par le praticien.
Pour être correctement pratiquées, ces manœuvres doivent être effectuées :
- sur un plan assez dur ;
- avec une durée d’application d’au moins 20 secondes avant de pouvoir conclure à la négativité de la manœuvre. L’application de la force doit être progressive car dans le cas où les articulations SI sont bien mécano-sensibles les manœuvres peuvent se révéler irritantes si elles sont réalisées brutalement. Si aucune douleur n’est ainsi provoquée, on peut réaliser quelques secousses en fin d’amplitude afin de s’assurer de la négativité du test.
- avec assez de force pour pouvoir mobiliser l’articulation SI et mettre en tension les ligaments qui la stabilisent ; en effet, la mobilité des articulations SI étant très faible (en moyenne, moins de 2° au maximum 4°) et les forces de verrouillage étant très importantes [17], il est primordial pour l’évaluateur d’être en mesure de transférer un maximum du poids de son corps dans les ASI (il semble qu’un poids de 25kg serait un minimum pour certaines manœuvres comme celle de Gaenslen) [1]. Cependant, il semble qu’il existe une grande variabilité dans les forces appliquées lors de ces manœuvres même chez des examinateurs expérimentés [20]. En effet, en pratique, il paraît difficile d’apprécier la force appliquée lors de chaque manœuvre. Retenons simplement que le.la praticien.ne doit parvenir à transférer (progressivement) un maximum de son poids de corps lors de l’application de la technique.
Clinimétrie des tests et des clusters : Un peu de maths (mais pas trop), c’est nécessaire vous allez voir !
Bien qu’il n’existe pas de consensus sur quelle serait la meilleure référence standard (« gold standard ») pour la lombalgie – et ce, quelle que soit la structure suspectée – les blocs d’anesthésique local restent le meilleur outil pour identifier une structure susceptible de contribuer aux douleurs [11, 12].
Afin de déterminer la performance diagnostique de ces deux clusters, les manœuvres ont été comparées à la meilleure (« meilleure », pas « parfaite » [1,43]) référence standard actuelle que constitue pour les DSI la double injection intra-articulaire d’anesthésique local (bloc initial : lidocaïne, courte durée d’action ; bloc de confirmation : bupivacaïne, longue durée d’action) guidée par fluoroscopie [11, 12]. Néanmoins, les critères pour la référence standard n’étaient pas exactement les mêmes (Figure 10) : Laslett considère une réponse positive à la référence standard si un soulagement de la douleur d’au moins 80% est obtenu, tandis que pour vDW une réduction de la douleur d’au moins 50% est requise [37, 39].
Cette référence standard en revanche n’est pas validée pour les douleurs en lien avec les structures extra-articulaires (ligaments) [44].
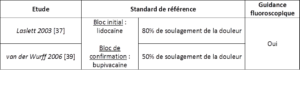
Figure 10 :
Comparaison des standards de référence pour les clusters de Laslett et van der Wurff
Pour rappel, si la sensibilité et la spécificité sont habituellement utilisées pour caractériser la performance diagnostique d’un test, les ratios de vraisemblance (positif : « RV+ », et négatif : « RV- ») devraient pourtant leur être préférées en pratique clinique car ces valeurs reflètent mieux le changement de probabilité d’une hypothèse [45]. Simplement : les RV positif et négatif représentent la capacité du test à augmenter ou à diminuer la probabilité que l’affection que l’on recherche avec ce test soit présente selon que le test est positif ou négatif (respectivement). On considère que le RV+ aboutira à une augmentation significative de la probabilité post-test par rapport à la probabilité pré-test (prévalence si accessible, ou appréciation du clinicien) si sa valeur est supérieure ou égale à 5. De même, on considère que le RV- aboutit à une diminution significative de la probabilité post-test si sa valeur est inférieure ou égale à 0,2. Plus sa valeur se rapproche de 1, moins un RV modifie la probabilité, et donc moins le test a d’utilité diagnostique [41, 46]. McGee a estimé que pour ces paliers de 5 et de 0,2, le changement approximatif de la probabilité est de +30 points et de -30 points de pourcentage, respectivement (Figure 11) [47].
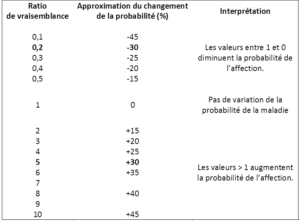
Figure 11 :
Ratios de vraisemblance et changement de probabilité estimé, traduit d’après [47]
(en gras, les valeurs « seuils » d’utilité clinique d’après [41])
La clinimétrie individuelle des tests constituant les deux clusters est synthétisée dans la Figure 12 ; les valeurs sont arrondies pour faciliter la lecture, sans que cela n’affecte fondamentalement leur précision diagnostique (tests du cluster de Laslett : Reproductibilité : [48], Précision : [38] ; pour le FABER : [32] (d’après [49, 50]).
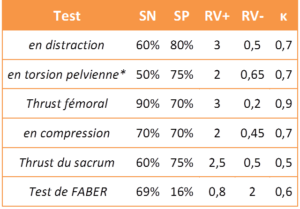
Figure 12 :
Tableau comparatif de la précision diagnostique et de la reproductibilité individuelle des tests inclus dans les clusters de Laslett et de van der Wurff
(SN : sensibilité, SP : spécificité, RV : ratio de vraisemblance, κ : kappa, *moyenne pour les côtés droit et gauche)
Avec le prisme des ratios de vraisemblances, on constate que la valeur individuelle de ces tests est globalement médiocre : aucun de ces tests ne permet, seul, d’aboutir à un changement significatif de la probabilité de l’hypothèse testée (Δ(post-test – pré-test) < 30%) [51].
Cependant, combiner judicieusement des tests peut permettre d’améliorer leur performance diagnostique globale, mais même en les associant ce gain peut rester marginal [52].
Alors comment interpréter les résultats d’une batterie de tests ? Pour faire simple, il s’agit d’abord de déterminer des paliers, ici : « 1 test positif sur 5 », « 2 tests positifs sur 5 », « 3 tests positifs sur 5 » et ainsi de suite, puis d’évaluer quel palier donne les meilleures performances diagnostiques.
Le tableau en Figure 13 récapitule et compare la clinimétrie de chaque palier de chaque cluster [53].

Figure 13 :
Comparaison de la clinimétrie des combinaisons de tests de Laslett et van der Wurff, adapté d’après [53]
Vous avez tenu jusque-là ? C’est maintenant que ça devient intéressant !
Dans ces clusters, le palier diagnostique optimal (cellules obscurcies) est « au moins 3 tests positifs sur 5 », seuil pour lequel le RV+ est de 4 environ [21, 54]. Cette règle diagnostique a été confirmée par vDW donc, mais aussi par deux études indépendantes ayant utilisé des tests similaires à ceux de Laslett et vDW [42, 55, 56].
De plus, une méta-analyse de 2009 rapporte pour la règle de « au moins 3 tests positifs » les données groupées de clinimétrie suivantes : une sensibilité de 85% et une spécificité de 76,4%, soit un RV+ de 3,6 et un RV- de 0,2, et calcule un rapport de côte diagnostique (diagnostic odd ratio) de 17,16 mais avec un large intervalle de confiance à 95% (7,6 – 39) avec la technique de double infiltration comme référence standard, confirmant ainsi l’utilité clinique de cette règle diagnostique [54].
Cliniquement, cela signifie que si au moins 3 tests sont positifs, il y aura une augmentation modérée de la probabilité de DSI (approximativement +25 points de pourcentage, selon [47]). Au contraire, si ce palier n’est pas atteint la probabilité que les douleurs soient en lien avec les ASI va diminuer significativement (au moins -30 points de pourcentage), nous permettant ainsi de rétrograder dans notre hiérarchie d’hypothèses une hypothèse qui était déjà peu probable dès le départ, et par conséquent d’envisager un diagnostic différentiel.
Pour aller plus loin dans l’interprétation de ces valeurs, si un seul test ou moins est positif, nous pouvons exclure avec une grande confiance l’hypothèse de DSI.
Cependant, dans le cas où 5 tests sont positifs sur 5, le RV+ est médiocre (gain sur la probabilité de l’hypothèse compris entre 0 et 15 points). Cela signifie que ce n’est pas parce qu’il y a plus de tests positifs que le diagnostic est plus certain ! Il faut donc être prudent quant aux conclusions à tirer d’un tel résultat.
Certains facteurs peuvent en effet sensibiliser les ASI et rendre les tests positifs alors que la douleur n’est pas en lien avec les structures articulaires en elles-mêmes (faux positifs).
D’abord, il serait judicieux d’exclure au préalable des tests de provocation des ASI toute affection lombaire plus prévalente que les DSI susceptible de mimer une DSI [25 – 31] et de générer de faux positifs aux tests [37]. Nous y reviendrons.
Chez les femmes enceintes, une hypersensibilité étendue des tissus (dont les mécanismes sous-jacents sont encore à élucider) est également susceptible de générer des faux positifs aux tests SI [57].
Enfin, face à un contexte de douleurs persistantes, il faut envisager la présence de phénomènes de facilitation de la nociception tels que la sensibilisation centrale, susceptibles d’aboutir à de l’hyperalgésie et donc à de faux positifs [58].
Intuitivement, on s’aperçoit déjà que prendre en compte et, si possible, dépister ces facteurs confondants au préalable de la réalisation des tests de provocation des ASI sera déterminant pour la confiance que l’on accordera à une réponse positive à ces tests.
Remarques concernant les clusters :
- Dans la mesure où les 2 clusters ont une validité diagnostique très proche, les tests de FABER et du thrust du sacrum peuvent par conséquent être intervertis si nécessaire sans que cela n’affecte fondamentalement la performance des clusters. Ainsi, on pourra réaliser le test de FABER eu lieu du test en thrust du sacrum chez les patients ne pouvant tolérer le décubitus ventral, en particulier chez les femmes enceintes.
- Laslett montre dans son étude de 2005, qui est une analyse secondaire de l’étude de 2003 [37] et dont la référence standard est cette fois un simple bloc anesthésique intra-articulaire, que le test de Gaenslen affecte peu la performance diagnostique du cluster (Figure 14) [38]. Limitant ainsi le nombre de tests à 4, le palier optimal devient : « au moins 2 tests positifs sur 4 ».

Figure 14 :
Comparaison de la clinimétrie du cluster de Laslett avec et sans le test de Gaenslen
- Plus récemment, Schneider et al. ont réévalués les 6 tests des clusters de Laslett et vDW (test de FABER, thrust fémoral, thrust du sacrum, test de distraction, test de compression, test de Gaenslen ; Figure 15). La référence standard à laquelle comparer les résultats des tests qui a été utilisée diffère de celles utilisées par Laslett et vDW en ceci qu’il s’agissait d’une unique injection guidée par fluoroscopie d’un mélange d’anesthésique local de courte durée d’action (lidocaïne, également utilisée dans les études de Laslett et vDW) et d’anti-inflammatoires stéroïdiens (glucocorticoïdes : triamcinolone) avec un soulagement de la douleur d’au moins 80%. Il n’y a donc pas de bloc de confirmation avec une anesthésie au long cours comme c’est le cas dans les études de Laslett et vDW.
Dans ces conditions expérimentales, aucune manœuvre ne présente de précision diagnostique susceptible d’aboutir à un changement significatif de probabilité. Autrement dit, dans cette étude, aucun de ces tests n’a d’utilité clinique [59]. Sur ce point, les résultats sont cohérents avec ceux de Laslett et vDW mais aussi avec ceux de Maigne et de Dreyfuss [60, 61] : isolément, ces tests n’ont pas d’utilité clinique.
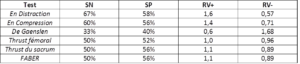
Figure 15 :
Tableau comparatif de la précision diagnostique individuelle des tests en comparaison avec un bloc diagnostic à 80% de soulagement de la douleur
(SN : sensibilité, SP : spécificité, RV : ratio de vraisemblance)
Ces tests ont également été évalués en combinaison : leur performance diagnostique a été calculée pour des seuils de soulagement de la douleur de 50%, 80% et 100%. Contrairement aux résultats de Laslett et vDW cette fois, aucune combinaison de tests pour aucun seuil de soulagement et pour aucun palier de tests positifs ne présente de RV+ qui indiquerait une utilité pour le diagnostic d’une DSI.
Avec tous ces éléments, on peut désormais résumer sous la forme d’un algorithme la combinaison de tests de Laslett et vDW avec le palier optimal de « au moins 2 tests positifs sur 4 » (Figure 16).
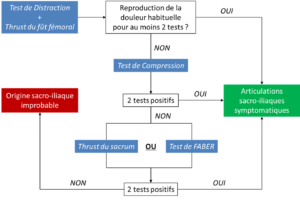
Figure 16 :
Algorithme des tests, adapté d’après [38]
Précautions préalables : Jusque-là c’était facile, c’est maintenant qu’il faut s’accrocher !
Mark Laslett (encore lui !) a montré dans son étude en 2003 que l’exclusion préalable d’une implication discogénique mécanique (DDM) à la douleur par une recherche infructueuse d’une centralisation (CEN) de la douleur par une approche MDT (« méthode McKenzie ») [37] permet d’augmenter la précision diagnostique des tests SI. En effet, il mettra en évidence en 2005 que le phénomène de CEN est très spécifique à une discographie de provocation contrôlée (donc à une douleur en lien avec le disque intervertébral) du moment où les sujets ne sont pas en détresse psycho-sociale ou en invalidité fonctionnelle importantes (mesurées sur le DRAM et sur l’échelle de Roland-Morris) [63]. Enfin, la prévalence de la CEN (et donc des douleurs discogéniques mécaniquement répondantes) semble se situer autour de 43% dans les lombalgies [64].
Lorsque les centraliseurs sont exclus, la spécificité du palier de « 3 tests positifs sur 5 » passe de 78% à 87%, améliorant ainsi le RV+ de 4 à 7 (le RV- ne change pas) ! Cela signifie qu’en excluant les centraliseurs, on obtient une réduction du nombre de faux positifs. En d’autres termes : si l’on n’exclut pas au préalable une implication lombaire mécanique, les tests SI sont susceptibles de générer plus de faux positifs !
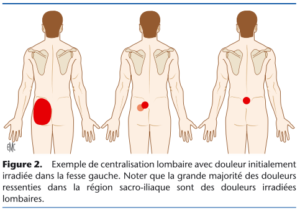
Figure 17 : [65]
En outre, si l’on considère l’ensemble des affections pouvant générer des douleurs référées dans le membre inférieur et que l’on en exclut un sous-groupe, il en résulte une augmentation relative de la probabilité des sous-groupes restant. Pour le dire autrement : en excluant une hypothèse, chaque hypothèse restante a plus de chances d’être le bon diagnostic qu’elle n’en avait au départ.
Donc, dans l’ensemble des causes de douleurs lombo-pelviennes persistantes, l’exclusion d’une implication discogénique par exemple résulte en une augmentation relative de la probabilité des causes possibles restantes, dont les DSI (Figure 18). Grâce à cette application en ligne (issue de l’excellente vidéo de Christophe Michel, de la chaîne Hygiène Mentale, sur le raisonnement bayésien), vous pouvez visualiser comment les variations de probabilité d’une hypothèse affecte la probabilité d’hypothèses concurrentes (vous pouvez également visualiser comment la probabilité a priori et la vraisemblance d’un test ou d’une expérience affectent la probabilité finale d’une hypothèse).
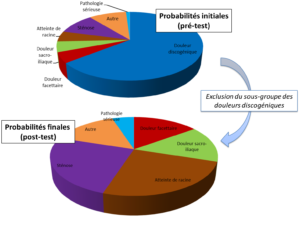
Figure 18 :
Evolution des probabilités relatives dans un groupe fini d’hypothèses lors de l’exclusion de l’une d’entre elles (les étiquettes cliniques et leurs proportions relatives ont été arbitrairement choisies pour l’exemple et ne se veulent pas réalistes).
Cela n’est peut-être pas très parlant, alors voyons comment l’exclusion des centraliseurs nous permet d’être plus confiant dans la conclusion de nos tests de provocation SI.
Si nous reprenons les conditions de l’étude de Laslett en 2003, la probabilité pré-test (prévalence) des DSI, passe de 26% à 32% après exclusion des centraliseurs. Or, nous avons vu que dans ces conditions le RV+ pour le palier optimal de 3 tests positifs sur 5 passe de 4 à 7 [53].
Mathématiquement, si la règle de « 3 tests positifs sur 5 » est remplie, il en résulte alors que la probabilité post-test que le patient ait une DSI passe de 32% à 77%, soit un gain total d’environ +50 points par rapport à la probabilité initiale (26%) ! Pour le dire autrement : l’exclusion des centraliseurs a permis au final un gain de près de +20 points sur la probabilité post-test par rapport à s’ils ne l’avaient pas été.
On peut essayer de clarifier les choses en représentant graphiquement l’évolution des probabilités avec un nomogramme de Fagan [66]. L’échelle de gauche représente la probabilité initiale (ou « pré-test ») de présence de la pathologie (ce qui correspond à la prévalence si elle est connue grâce à l’épidémiologie, ou à défaut, à l’estimation du clinicien a priori selon les indices cliniques en présence), celle du milieu représente la valeur des ratios de vraisemblance du test et celle de droite représente la probabilité finale après avoir réalisé le test (probabilité post-test). Les droites de couleur modélisent le changement de probabilité permis par les RV (positif en bleu, négatif en rouge). Les crochets symbolisent les intervalles de confiance à 95%. Ainsi, ce graphique nous permet de visualiser dans quelle mesure un test dont on connaît les RV contribue à modifier (augmenter ou diminuer) la probabilité de présence d’une pathologie (Figure 19).
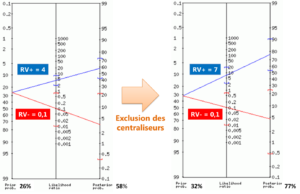
Figure 19 :
Illustration des changements de probabilités pour une règle de « au moins 3 tests positifs remplie » avant et après exclusion des sujets centraliseurs pour une prévalence initiale de 26%.
(réalisée avec : http://araw.mede.uic.edu/cgi-bin/testcalc.pl)
En résumé :
L’exclusion préalable des centraliseurs a permis à la fois de rehausser la probabilité pré-test de l’hypothèse SI, mais aussi d’améliorer le RV+ du cluster de Laslett, ce qui aboutit, une fois les tests SI réalisés, à une probabilité de l’hypothèse de DSI significativement plus élevée (Figure 20).
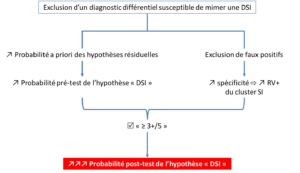
Figure 20 :
Résumé schématique des effets probabilistes sur l’hypothèse de DSI de l’exclusion d’une hypothèse concurrente
Tout ça pour démontrer que l’ordre dans laquelle les différentes hypothèses sont testées, inclues et exclues, a une importance capitale en pratique clinique car il peut influencer les résultats des tests et les changements de probabilités des hypothèses. Retenons que le résultat d’un test pour une hypothèse pourra nous conduire à une conclusion clinique différente selon l’exclusion préalable ou non d’un ou plusieurs diagnostics différentiels.
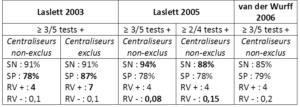
Figure 21 :
Tableau récapitulatif de la clinimétrie des clusters de Laslett et van Der Wurff
(SN : sensibilité / SP : spécificité / RV : ratio de vraisemblance / les valeurs en gras soulignent les différences de valeurs d’une situation à l’autre au sein d’une même étude)
Il n’est pas exclu que d’autres sources lombaires de nociception que le disque intervertébral soient capables de produire de faux positifs aux tests SI mais cela reste à étudier.
En extrapolant on peut néanmoins considérer que, étant donné la faible prévalence des DSI, on ne peut se dispenser d’exclure dans un premier temps toute autre cause plus courante – et donc plus probable – de douleur lombo-pelvienne ou de douleur référée somatique du membre inférieur, et a fortiori si elle est susceptible de mimer une DSI et de générer des faux positifs aux tests SI, avant de considérer l’éventualité d’une DSI [67].
Mark Laslett (toujours lui !) suggère d’ailleurs que s’il existe un autre diagnostic plus susceptible d’expliquer les douleurs pelviennes ou des membres inférieurs, les résultats des tests de provocations SI doivent être ignorés et considérés comme des faux positifs [14, 16], d’autant qu’il est peu commun que deux structures impliquées dans des douleurs lombo-pelviennes coexistent [68, 69].
D’autres structures connues pour être en lien avec des douleurs référées somatiques pelviennes ou dans le membre inférieur sont présentées dans le tableau ci-après (Figure 22). Elles constituent une liste non-exhaustive de diagnostics différentiels des DSI à envisager (chacun ayant une prévalence particulière). En particulier, une éventuelle implication de la hanche est à également à exclure avant de tester les ASI étant donné que cette région est largement sollicitée par les tests SI.
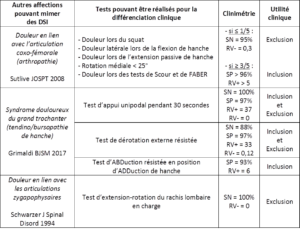
Figure 22 :
(SN : sensibilité, SP : spécificité, RV : ratio de vraisemblance)
Evidemment en pratique il est difficile, sinon impossible, de rendre compte avec précision de ces phénomènes statistiques : d’une part nous ne disposons pas toujours de toutes les données nécessaires au calcul (épidémiologie, clinimétrie) et d’autre part il est évident qu’il ne s’agit pas de réaliser ces calculs au cours d’une consultation ! Mais l’objectif ici est, en se servant de l’exemple des DSI, d’illustrer comment la hiérarchisation probabiliste des hypothèses, l’ordre et les valeurs clinimétriques des tests nous permettent d’argumenter plus fiablement nos conclusions cliniques, et dans quelle mesure il est déterminant pour nos décisions cliniques d’appréhender les mécanismes du changement de probabilité.
À défaut d’être assisté par une intelligence artificielle recensant pour nous toutes les données nécessaires à ces calculs, le praticien doit faire appel à ses compétences de jugement afin d’apprécier « au doigt mouillé » les changements de probabilité. Si l’objectif du clinicien est de pouvoir faire confiance à ses conclusions, une compréhension fine des ressorts d’un raisonnement probabiliste, des outils mathématiques et de l’influence de la façon dont est conduit un examen clinique sur la probabilité des hypothèses est fondamentale. L’expertise du praticien a donc encore de beaux jours devant elle !
Objection sur le rôle de la centralisation dans le diagnostic différentiel de DSI :
Nous avons dit que dans l’étude de Laslett en 2003 [37], l’exclusion d’une DDM a été réalisée avec l’approche MDT (« méthode McKenzie ») par la recherche infructueuse d’une CEN à l’aide de stratégies de mise en contrainte directionnelle du rachis lombaire (mouvements répétés ou positions maintenues).
Sauf que Laslett lui-même a montré ensuite en 2005 que, dans les conditions de son étude, la CEN n’a pas une bonne capacité d’exclusion pour les douleurs discogéniques mécaniques (RV- ≈ 0,6, Figure 23) [70], donnée soutenue par les travaux de Young en 2003 (RV- = 0,5) [26].
Ainsi, des patients qui ne centralisent pas peuvent quand même présenter une DDM (faux négatifs). En d’autres termes : tous les patients avec une DDM ne centralisant pas, l’absence de CEN ne suffit donc pas à exclure une implication discogénique mécanique !
Laslett a d’ailleurs lui-même présenté ici des résultats de la comparaison entre la présence d’une préférence directionnelle (P.D.) sans CEN (dont elle est un cas particulier, Figure 24) et un résultat positif à une discographie de provocation, montrant que, comme la CEN, la P.D. est utile pour inclure une DDM, et comme la CEN, la P.D. ne permet pas d’exclure une contribution discale mécanique à la douleur (Figure 23 ; plus d’informations à ce sujet dans une publication antérieure à la création de Kinéfact, ici).
Ces résultats – qui doivent être considérés avec précaution car ils n’ont à ma connaissance pas été publiés dans une revue à comité de relecture par les pairs – suggèrent à nouveau qu’il existe encore un sous-groupe de patients souffrant de DDM qui ne présentent ni P.D., ni CEN, dont on peut imaginer qu’il puisse également générer de faux positifs aux tests SI s’ils ne sont pas préalablement exclus.
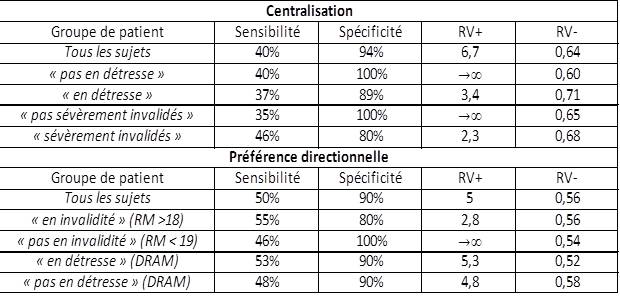
Figure 23 :
Comparaison de la précision diagnostique de la centralisation et de la préférence directionnelle en fonction du risque psycho-social, d’après Laslett
(RM : Echelle de Roland-Morris ; DRAM : Distress and Risk Assessment Method)
Nota Bene : pour une raison inconnue, les valeurs des RV diffèrent de celles présentes dans l’étude de Laslett 2005 [70] ; elles ont été recalculées à partir des valeurs de la sensibilité et de la spécificité disponibles dans l’étude et vérifiées avec calculateur de précision diagnostique (ici). Ce sont donc ces dernières qui ont été gardées.
Figure 24 :
En MDT, la centralisation est considérée comme un cas particulier de la préférence directionnelle
De ces résultats, on remarque que si la capacité de la CEN et de la P.D. à diagnostiquer une DDM n’est pas indépendante de la détresse psycho-sociale et de l’invalidité, leur capacité d’exclusion en revanche n’est pas affectée par ces facteurs.
Enfin, bien qu’il soit tout à fait envisageable que d’autres approches permettent de dépister une implication discogénique mécanique (auquel cas elles doivent être évaluées formellement dans une étude diagnostique avec comparaison aux résultats d’une discographie de provocation contrôlée), les résultats de l’étude de Laslett ne peuvent à ce jour être considérés qu’à travers l’approche MDT.
Ultimement, les tests SI peuvent aider le clinicien à identifier les cas susceptibles de bénéficier ensuite d’une injection intra-articulaire d’anesthésique à visée diagnostique, permettant, en confirmant l’hypothèse, de mieux orienter la prise en charge thérapeutique [1].
Articles précédents : Parties 1 (épidémiologie) et 2 (anamnèse) :
https://www.kinefact.com/troubles-musculo-squelettiques/examen-sacro-iliaques-1
https://www.kinefact.com/troubles-musculo-squelettiques/examen-sacro-iliaques-2
Suite de cet article : Partie 4 (conclusion) :
https://www.kinefact.com/troubles-musculo-squelettiques/examen-sacro-iliaques-4
Références : (par ordre d’apparition dans le texte)
- Berthelot JM, Laslett M. Par quels signes cliniques s’assurer au mieux qu’une douleur est bien d’origine sacro-iliaque (sensu lato) ? Revue du Rhumatisme Sept 2009;76(8):741-749
- van der Wurff et al. Clinical tests of the sacroiliac joint. A systematic methodological review. Part 1: Reliability. Man Ther. 2000 Feb;5(1):30-6
- Haneline MT, Young M. A review of intraexaminer and interexaminer reliability of static spinal palpation: a literature synthesis. J Manipulative Physiol Ther. 2009 Jun;32(5):379-86
- Stoval BA, Kumar S. Reliability of bony anatomic landmark asymmetry assessment in the lumbopelvic region: application to osteopathic medical education. J Am Osteopath Assoc. 2010 November;110(11):667–674
- Cooperstein R, Hickey M. The reliability of palpating the posterior superior iliac spine: a systematic review. J Can Chiropr Assoc. 2016 Mar;60(1):36-46
- Wu WH, et al. Pregnancy-related pelvic girdle pain (PPP), I: Terminology, clinical presentation, and prevalence. Eur Spine J. 2004 Nov;13(7):575-89
- Vleeming A, et al. European guidelines for the diagnosis and treatment of pelvic girdle pain. Eur Spine J. 2008 Jun;17(6):794-819
- Kanakaris K, Roberts CS, Giannoudis PV. Pregnancy-related pelvic girdle pain: an update. BMC Med. 2011 Feb 15;9:15
- Vermani E, Mittal R, Weeks A. Pelvic girdle pain and low back pain in pregnancy: a review. Pain Pract. 2010 Jan-Feb;10(1):60-71
- Stolwijk C, et al. Global Prevalence of Spondyloarthritis: A Systematic Review and Meta‐Regression Analysis. Arthritis Care Res (Hoboken). 2016 Sep;68(9):1320-31
- Simopoulos TT, et al. A systematic evaluation of prevalence and diagnostic accuracy of sacroiliac joint interventions. Pain Physician. 2012 May-Jun;15(3):E305-44
- Simopoulos TT, et al. Systematic Review of the Diagnostic Accuracy and Therapeutic Effectiveness of Sacroiliac Joint Interventions. Pain Physician. 2015 Sep-Oct;18(5):E713-56
- Laslett M. Commentary on Appropriate Use Criteria for SIJ Pain. Pain Med. 2018 Apr 26
- Chou LH, et al. Inciting Events Initiating Injection-Proven Sacroiliac Joint Syndrome. Pain Med. 2004 Mar;5(1):26-32
- Bogduk N. Clinical Anatomy of the Lumbar Spine and Sacrum. 5e edition 2012. Elsevier Health Sciences.
- Laslett M. Clinical Diagnosis of Sacroiliac Joint Pain. Techniques in Orthopaedics: June 2019 – Volume 34 – Issue 2 – p 76–86
- Vleeming A, et al. The sacroiliac joint: an overview of its anatomy, function and potential clinical implications. J Anat. 2012 Dec;221(6):537-67
- Murakami E, et al. Leg symptoms associated with sacroiliac joint disorder and related pain. Clin Neurol Neurosurg. 2017 Jun;157:55-58
- Szadek KM, et al. Possible Nociceptive Structures in the Sacroiliac Joint Cartilage: An Immunohistochemical Study. Clin Anat. 2010 Mar;23(2):192-8
- Berthelot JM, et al. Provocative sacroiliac joint maneuvers and sacroiliac joint block are unreliable for diagnosing sacroiliac joint pain. Joint Bone Spine. 2006 Jan;73(1):17-23
- Vanelderen P, et al. 13. Sacroiliac joint pain. Pain Pract. 2010 Sep-Oct;10(5):470-8
- Fortin JD, et al. Sacroiliac joint: pain referral maps upon applying a new injection/arthrography technique. Part I: Asymptomatic volunteers. Spine (Phila Pa 1976). 1994 Jul 1;19(13):1475-82
- Dreyfuss P, et al. Sacroiliac joint pain. J Am Acad Orthop Surg. 2004 Jul-Aug;12(4):255-65
- Slipman CW, et al. Sacroiliac joint pain referral zones. Arch Phys Med Rehabil. 2000 Mar;81(3):334-8
- van der Wurff P, Buijs EJ, Groen GJ. Intensity Mapping of Pain Referral Areas In Sacroiliac Joint Pain Patients. J Manipulative Physiol Ther. 2006 Mar-Apr;29(3):190-5
- Young S, Aprill C, Laslett M. Correlation of clinical examination characteristics with three sources of chronic low back pain. Spine J. 2003 Nov-Dec;3(6):460-5
- Grimm BD, et al. Mimickers of lumbar radiculopathy. J Am Acad Orthop Surg. 2015 Jan;23(1):7-1
- Gellhorn AC, et al. Osteoarthritis of the spine: the facet joints. Nat. Rev. Rheumatol. 9, 216–224 (2013)
- Lesher JM et al. Hip joint pain referral patterns: a descriptive study. Pain Med. 2008 Jan-Feb;9(1):22-5
- Kim HG, et al. Clinical and Radiological Findings of Discogenic Low Back Pain Confirmed by Automated Pressure-Controlled Discography. J Korean Neurosurg Soc. 2009 Oct; 46(4): 333–339
- Bogduk N. On the definitions and physiology of back pain, referred pain, and radicular pain. PAIN 147 (2009) 17–19
- Dreyfuss P, et al. The value of medical history and physical examination in diagnosing sacroiliac joint pain. Spine. 1996 Nov 15;21(22):2594–602
- Hartvigsen J et al. What low back pain is and why we need to pay attention. Lancet. 2018 Jun 9;391(10137):2356-2367
- Feldtkeller E, Rudwaleit M, Zeidler H. Easy probability estimation of the diagnosis of early axial spondyloarthritis by summing up scores. Rheumatology (Oxford). 2013 Sep;52(9):1648-50
- Baraliakos X, Maksymowych WP, Imaging in the diagnosis and management of axial spondyloarthritis, Best Practice & Research Clinical Rheumatology (2016)
- Eno JJ et al. The prevalence of sacroiliac joint degeneration in asymptomatic adults. J Bone Joint Surg Am. 2015 Jun 3;97(11):932-6
- Laslett et al. Diagnosing painful sacroiliac joints: A validity study of a McKenzie evaluation and sacroiliac provocation tests. Aust J Physiother. 2003;49(2):89-97
- Laslett M. Diagnosis of sacroiliac joint pain: validity of individual provocation tests and composites of tests. Man Ther. 2005 Aug;10(3):207-18
- van der Wurff et al. A Multitest Regimen of Pain Provocation Tests as an Aid to Reduce Unnecessary Minimally Invasive Sacroiliac Joint Procedures. Arch Phys Med Rehabil. 2006 Jan;87(1):10-4
- Bogduk N. Pain provocation tests for the assessment of sacroiliac joint dysfunction. J Spinal Disord. 1999 Aug;12(4):357-358
- Cook C, Hegedus E. Orthopedic Physical Examination Tests: An Evidence-Based Approach – Pearson New International Edition. 2nd Edition 2017
- Ozgocmen S et al. The value of sacroiliac pain provocation tests in early active sacroiliitis. Clin Rheumatol. 2008 Oct;27(10):1275-82
- Laslett M et al. Comments on Berthelot et al. review: ‘‘Provocative sacroiliac joint maneuvers and sacroiliac joint block are unreliable for diagnosing sacroiliac joint pain. Joint Bone Spine. 2007 May;74(3):306-7
- Bogduk N. A Commentary on Appropriate Use Criteria for Sacroiliac Pain. Pain Medicine 2017; 18: 2055–2057
- Hegedus EJ, Stern B. Beyond SpPIN and SnNOUT: Considerations with Dichotomous Tests during Assessment of Diagnostic Accuracy. J Man Manip Ther. 2009;17(1):E1-5
- Joshua Cleland, Michel Pillu, Shane Koppenhaver, Jonathan Su. Examen clinique de l’appareil locomoteur. Elsevier Masson. 3ème édition 2018
- McGee S. Simplifying likelihood ratios. J Gen Intern Med. 2002 Aug;17(8):646-9
- Laslett M, Williams M. The reliability of selected pain provocation tests for sacroiliac joint pathology. Spine (Phila Pa 1976). 1994 Jun 1;19(11):1243-9
- van der Wurff P, Hagmeijer RH, Meyne W. Clinical tests of the sacroiliac joint. A systematic methodological review. Part 1: Reliability. Man Ther. 2000 May;5(1):30-6
- van der Wurff P, Hagmeijer RH, Meyne W. Clinical tests of the sacroiliac joint. A systematic methodological review. Part 2: Validity. Man Ther. 2000 Feb;5(2):89-96
- Sivayogam A, Banerjee A. Diagnostic performance of clinical tests for sacroiliac joint pain. Physical Therapy Reviews. 2011 Dec;16(6):462-7
- Hegedus, E. J., et al., Combining orthopedic special tests to improve diagnosis of shoulder pathology. Phys Ther Sport. 2015 May;16(2):87-92
- Laslett M. Evidence-based diagnosis and treatment of the painful sacroiliac joint. J Man Manip Ther. 2008;16(3):142-52
- Szadek KM et al. Diagnostic validity of criteria for sacroiliac joint pain: a systematic review. J Pain. 2009;10:354–368
- Petersen T, Laslett M, Juhl C. Clinical classification in low back pain: best-evidence diagnostic rules based on systematic reviews. BMC Musculoskelet Disord. 2017 May 12;18(1):188
- Stanford G, Burnham RS. Is it useful to repeat sacroiliac joint provocative tests post-block? Pain Med. 2010 Dec;11(12):1774-6
- Palsson TS, et al. Pregnancy is characterized by widespread deep-tissue hypersensitivity independent of lumbopelvic pain intensity, a facilitated response to manual orthopedic tests, and poorer self-reported health. J Pain. 2015 Mar;16(3):270-82
- Osinski T, et al. Modulation et dérèglements neurophysiologiques des voies de la douleur. Kinesither Rev. 2017 Jun;17(186):16-32
- Schneider BJ, et al. Validity of Physical Exam Maneuvers in the Diagnosis of Sacroiliac Joint Pathology. Pain Med. 2019 Aug 8
- Maigne JY, Aivaliklis A, Pfefer F. Results of sacroiliac joint double block and value of sacroiliac pain provocation tests in 54 patients with low back pain. Spine (Phila Pa 1976). 1996 Aug 15;21(16):1889-92
- Dreyfuss P, et al. The value of medical history and physical examination in diagnosing sacroiliac joint pain. Spine (Phila Pa 1976). 1996 Nov 15;21(22):2594-602
- Kennedy DJ, et al. Fluoroscopically Guided Diagnostic and Therapeutic Intra-Articular Sacroiliac Joint Injections: A Systematic Review. Pain Med. 2015 Aug;16(8):1500-18
- Laslett M et al. Centralization as a predictor of provocation discography results in chronic low back pain, and the influence of disability and distress on diagnostic power. Spine J. 2005 Jul-Aug;5(4):370-80
- May S, Aina A. Centralization and directional preference: a systematic review. Man Ther. 2012 Dec;17(6):497-506
- Sagi, P. Boudot, D. Vandeput. Méthode McKenzie : diagnostic et thérapie mécanique du rachis et des extrémités. 04/02/11. [26-076-A-10]
- Fagan TJ. Nomogram for Bayes’s theorem. N Engl J Med. 1975 ; 293 : 257
- Vleeming A et al. European guidelines for the diagnosis and treatment of pelvic girdle pain. Eur Spine J 2008;17:794–819
- Schwarzer AC, et al. The relative contributions of the disc and zygapophyseal joint in chronic low back pain. Spine (Phila Pa 1976). 1994 Apr 1;19(7):801-6
- Laslett M, et al. Agreement between diagnoses reached by clinical examination and available reference standards: a prospective study of 216 patients with lumbopelvic pain. BMC Musculoskelet Disord. 2005;6:28
- Laslett M, et al. Centralization as a predictor of provocation discography results in chronic low back pain, and the influence of disability and distress on diagnostic power. Spine J. 2005 Jul-Aug;5(4):370-80


4 Commentaires
OTERO Jacky
Un grand bravo pour la qualité et l’exhaustivité de ce travail.
Merci beaucoup
Joshua LAVALLÉE
Merci beaucoup Jacky pour ton retour ! J’espère que la suite de ce travail t’aura plu également.
Ism@
Bonjour,
A la conclusion faite après les différents seuils des SP et SN des clusters de Laslett et vDW, vous notez: « Pour aller plus loin dans l’interprétation de ces valeurs, si un seul test ou moins est positif, nous pouvons exclure avec une grande confiance l’hypothèse de DSI. »
Nous sommes d’accord que c’est la Négativité sur un des ces tests qui nous permet d’exclure l’hypothèse de DSI?
Joshua LAVALLÉE
En fait on peut considérer les choses de 2 façons : on peut exclure avec confiance SI :
– seulement 1 test ou moins (aucun donc) est positif
– ou si au moins 4 tests sont négatifs
Cela revient au même.
En espérant avoir répondu à votre interrogation.
Merci de nous lire et merci de nous avoir sollicité.
Bonne journée