Aide à la relecture : Marguerite Dontenwille, Robin Vervaeke, Anthony Halimi, Bryan Littré, Théo Chaumeil, Clément Loiseau
Abréviations :
ASI : articulation(s) sacro-iliaque(s)
DSI : douleur(s) en lien avec les articulations sacro-iliaques
SpA : spondylarthrite
vDW : van Der Wurff
CEN : centralisation
P.D. : préférence directionnelle
DDM : douleur(s) discogénique(s) mécanique(s)
Partie 1 (épidémiologie) de cet article :
Caractéristiques de la douleur en lien avec les articulations sacro-iliaques
Les ASI sont-elles impliquées dans des phénomènes douloureux ?
Il existe peu d’études qui décrivent l’innervation de l’articulation sacro-iliaque (ASI), et les quelques études récentes à ce sujet donnent des résultats conflictuels. On peut néanmoins retenir des études à notre disposition que l’innervation de l’ASI, bien que variable, provient principalement des branches dorsales sacrées [11, 15, 17].
L’injection intra-articulaire de produit de contraste chez des volontaires sains produit une douleur somatique localisée autour de l’ASI ainsi que des schémas variables de douleur somatique référée (douleur irradiante sans affection du tissu nerveux) dans le membre inférieur [15]. De même, l’injection intra-articulaire d’anesthésique est en mesure d’abolir des douleurs chez des sujets déjà symptomatiques [11]. Les structures intra-articulaires (surfaces articulaires, ligament interosseux et capsule) sont donc susceptibles de contribuer aux douleurs.
L’injection d’anesthésique dans ou autour des structures ligamentaires extra-articulaires chez des sujets symptomatiques permet également d’abolir des douleurs, suggérant leur capacité à constituer une autre source potentielle de nociception [18].
Une étude immunohistochimique a d’ailleurs mis en évidence dans la couche superficielle du cartilage iliaque et sacré ainsi que dans les structures ligamentaires environnantes la présence de médiateurs de la nociception (substance P et peptide relié au gène calcitonine) [19].
En conclusion, les structures intra- et extra-articulaires des ASI semblent toutes capables de nociception et donc susceptibles de contribuer à la douleur isolément, ou en combinaison. En revanche, la contribution relative de chaque structure aux douleurs reste à déterminer.
Quelles sont les caractéristiques des DSI ?
Il n’existe pas de consensus concernant la topographie des DSI [1]. Néanmoins, il est possible de dégager des études sur la cartographie des DSI quelques caractéristiques récurrentes.
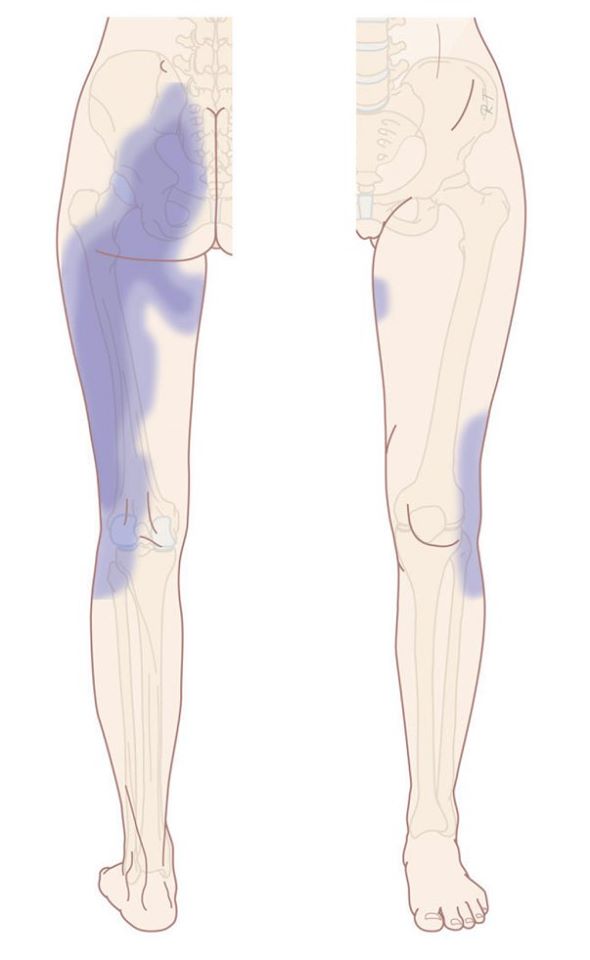
Ainsi, la DSI « typique » est le plus souvent unilatérale, sauf dans le cas d’une inflammation, notamment systémique (SpA), où elle peut être unilatérale, « à bascule » (alterner d’un côté et de l’autre sans raison apparente), ou bilatérale. Habituellement postérieure et dominante à la fesse (antérieure, à la cuisse possible mais plus rare), des projections sont possibles dans le membre inférieur (Figure 4) selon des schémas variables selon les études. Ces douleurs référées somatiques sont possibles jusqu’au pied mais plus la douleur est distale plus la probabilité pour qu’elle soit originaire des ASI est faible [15, 18, 20 – 25]. Enfin, elle ne « remonte » (presque) jamais au-dessus des ASI ; c’est pourquoi toute douleur présente au-dessus de la ligne des EIPS (ou du processus épineux de L5) doit nous inciter à exclure une origine SI et à envisager plutôt une origine lombaire [26].
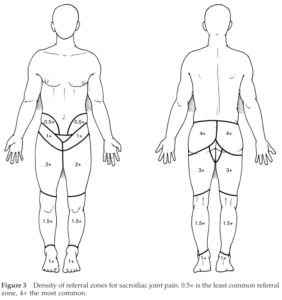
Figure 4 :
Densité des territoires référés de DSI, 4+ étant le plus courant et 0.5+ le moins courant
([23] d’après [24])
Cependant, les ASI ne sont pas les seules structures du rachis et du membre inférieur susceptibles d’être en lien avec des douleurs référées somatiques pelviennes ou dans le membre inférieur : le disque intervertébral, les articulations zygapophysaires, l’articulation coxo-fémorale et les structures molles de la hanche sont autant de sources possibles de nociception dont la cartographie des douleurs référées peut se superposer à celle des ASI (Figure 5). Ainsi, la seule cartographie des douleurs référées somatiques du membre inférieur ne permet pas de différencier les patients avec une DSI de ceux ayant des symptômes en lien avec d’autres structures [20, 25, 27 – 30].
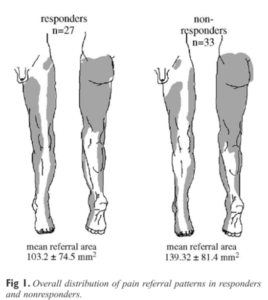
Figure 5 :
Comparaison des cartographies de la douleur chez des patients souffrant de douleurs lombo-pelviennes persistantes. À gauche : répondeurs à une double injection intra-articulaire d’anesthésique (suggérant que l’ASI est bien symptomatique) ; à droite : non-répondeurs.
Une piste semble néanmoins exister du côté de la distribution de l’intensité douloureuse (Figure 6). En effet, les sujets dont la contribution des ASI est suggérée par la réponse positive à une double injection intra-articulaire d’anesthésique sont plus susceptibles d’éprouver une douleur plus intense dans le massif fessier ; alors que les non-répondeurs à la double injection ont une douleur plutôt prédominante en regard du pli sous-fessier (ischiatique) [25].
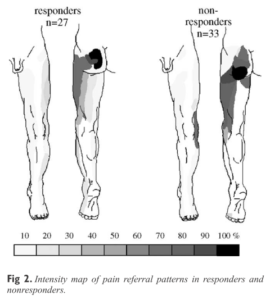
Figure 6 :
Comparaison de la distribution de l’intensité douloureuse entre répondeurs (origine SI) et non-répondeurs (autre étiologie) à une double injection intra-articulaire d’anesthésique
Cependant, les douleurs référées somatiques sont le plus souvent profondes, mal systématisées [31] et le patient peut avoir du mal à localiser et à quantifier avec précision ses douleurs, ce qui peut constituer un obstacle à une telle démarche de cartographie de la douleur et de son intensité en pratique clinique. Les dessins de la douleur ainsi que des applications pour appareils électroniques peuvent être utiles pour ce faire mais leur pertinence pour le diagnostic de DSI reste à être étudiée.
Autres éléments de l’anamnèse
Apparition des symptômes :
Que ce soit suite à un traumatisme (40%), suite à une sollicitation mécanique exceptionnelle (21%) ou en lien avec la grossesse (20%), la majorité des DSI semble prendre place dans un contexte évocateur. Ainsi, une douleur apparue dans un contexte, par exemple, de post-partum immédiat ou de chute sur le flanc doit nous inciter à prendre plus au sérieux l’hypothèse d’une DSI (augmentation relative de la probabilité a priori en faveur de l’hypothèse de DSI).
Néanmoins, une apparition spontanée est possible, et si elle semble concerner une proportion non-négligeable des DSI au sein du groupe des « lombalgies » chroniques (35%), l’absence de contexte évocateur particulier malgré un tableau de DSI pertinent devrait d’abord nous inciter à envisager l’hypothèse d’une SpA. Les premières manifestations de la SpA apparaissent habituellement de façon insidieuse (sans explication traumatique ou mécanique évidente) entre 20 et 40 ans, avec une très faible prédominance masculine. Elle est caractérisée par une raideur matinale (durant plus de 45 minutes), s’améliorant avec l’exercice physique et pas avec le repos, ainsi que par des douleurs réveillant le patient la nuit [16, 33]. Outre une douleur d’horaire inflammatoire (RV+ = 3), d’autres indices doivent nous faire suspecter une SpA, notamment la présence de signes non-rachidiens d’inflammation tels qu’une pathologie inflammatoire chronique de l’intestin (RV+ = 4), la présence de douleur talonnière (enthésite, RV+ = 3,4), une arthrite des membres périphériques (RV+ = 4), une dactylite (RV+ = 4,5), une uvéite antérieure (RV+ = 7,3), du psoriasis (RV+ = 2,5), ainsi qu’une histoire familiale de rhumatisme inflammatoire (RV+ = 6,4), une bonne réponse aux AINS (RV+ = 5), et un marqueur HLA-B27 positif (RV+ = 9) [34].
Note : nous reviendrons sur la signification des ratios de vraisemblance (RV) dans le prochain billet de blog.
En cas de suspicion de SpA, l’IRM sera utile pour rechercher une sacro-iliite active en particulier en phase précoce de la pathologie contrairement à la radiographie simple qui ne montrera les remaniements des articulations qu’à un stade plus avancé de la pathologie (Figure 7) [35].
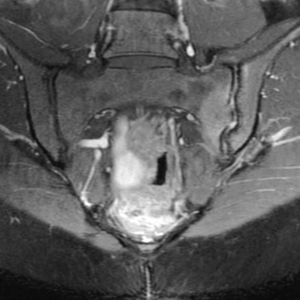
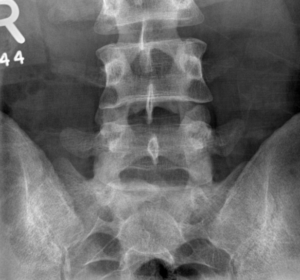
Figures 7 :
Comparaison entre une sacro-iliite gauche active vue à l’IRM au-dessus, et une ankylose bilatérale des ASI vue sur une radiographie de face en-dessous.
(Crédit : https://radiopaedia.org/cases/chronic-sacroiliitis?lang=us)
A ce sujet, notons que l’on retrouve une dégénérescence d’au moins une ASI chez près de 65% de la population asymptomatique, dont environ 30% de changements dégénératifs substantiels. Cette prévalence augmente avec l’âge, ce qui ne manque pas de nous rappeler que l’imagerie seule ne nous permet pas toujours de tirer des conclusions cliniques pertinentes (Figure 8) [36].
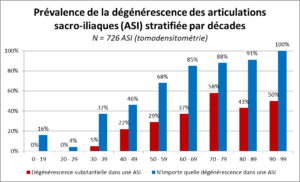
Figure 8 : (d’après [36])
Activités :
La présence ou l’absence de douleur lors des activités comme la station debout, la marche, la position assise ou allongée ainsi que lors de la toux ne sont pas associées avec une injection diagnostique intra-articulaire positive [32]. Autrement dit : la présence ou l’absence de douleur lors de ces activités ne nous permettent pas de nous renseigner sur la présence d’une DSI.
En revanche, la douleur lors du passage à la station debout depuis la position assise semble être omniprésente chez les sujets souffrant de DSI. Mais ce signe manque de spécificité puisqu’on le retrouve également chez des sujets ne souffrant pas de DSI mais de douleurs discogéniques [26].
En définitive, même si un certain nombre d’éléments nous autorisent plus ou moins à suspecter une DSI, nous n’avons à ce stade aucun schéma de douleur ou indice dans l’interrogatoire du patient qui suffise pour diagnostiquer avec précision cette condition.
Article précédent : Partie 1 (épidémiologie) :
Suite de cet article : Parties 3 (tests orthopédiques) et 4 (conclusion) :
https://www.kinefact.com/troubles-musculo-squelettiques/examen-sacro-iliaques-3
https://www.kinefact.com/troubles-musculo-squelettiques/examen-sacro-iliaques-4
Références : (par ordre d’apparition dans le texte)
- Berthelot JM, Laslett M. Par quels signes cliniques s’assurer au mieux qu’une douleur est bien d’origine sacro-iliaque (sensu lato) ? Revue du Rhumatisme Sept 2009;76(8):741-749
- van der Wurff et al. Clinical tests of the sacroiliac joint. A systematic methodological review. Part 1: Reliability. Man Ther. 2000 Feb;5(1):30-6
- Haneline MT, Young M. A review of intraexaminer and interexaminer reliability of static spinal palpation: a literature synthesis. J Manipulative Physiol Ther. 2009 Jun;32(5):379-86
- Stoval BA, Kumar S. Reliability of bony anatomic landmark asymmetry assessment in the lumbopelvic region: application to osteopathic medical education. J Am Osteopath Assoc. 2010 November;110(11):667–674
- Cooperstein R, Hickey M. The reliability of palpating the posterior superior iliac spine: a systematic review. J Can Chiropr Assoc. 2016 Mar;60(1):36-46
- Wu WH, et al. Pregnancy-related pelvic girdle pain (PPP), I: Terminology, clinical presentation, and prevalence. Eur Spine J. 2004 Nov;13(7):575-89
- Vleeming A, et al. European guidelines for the diagnosis and treatment of pelvic girdle pain. Eur Spine J. 2008 Jun;17(6):794-819
- Kanakaris K, Roberts CS, Giannoudis PV. Pregnancy-related pelvic girdle pain: an update. BMC Med. 2011 Feb 15;9:15
- Vermani E, Mittal R, Weeks A. Pelvic girdle pain and low back pain in pregnancy: a review. Pain Pract. 2010 Jan-Feb;10(1):60-71
- Stolwijk C, et al. Global Prevalence of Spondyloarthritis: A Systematic Review and Meta‐Regression Analysis. Arthritis Care Res (Hoboken). 2016 Sep;68(9):1320-31
- Simopoulos TT, et al. A systematic evaluation of prevalence and diagnostic accuracy of sacroiliac joint interventions. Pain Physician. 2012 May-Jun;15(3):E305-44
- Simopoulos TT, et al. Systematic Review of the Diagnostic Accuracy and Therapeutic Effectiveness of Sacroiliac Joint Interventions. Pain Physician. 2015 Sep-Oct;18(5):E713-56
- Laslett M. Commentary on Appropriate Use Criteria for SIJ Pain. Pain Med. 2018 Apr 26
- Chou LH, et al. Inciting Events Initiating Injection-Proven Sacroiliac Joint Syndrome. Pain Med. 2004 Mar;5(1):26-32
- Bogduk N. Clinical Anatomy of the Lumbar Spine and Sacrum. 5e edition 2012. Elsevier Health Sciences.
- Laslett M. Clinical Diagnosis of Sacroiliac Joint Pain. Techniques in Orthopaedics: June 2019 – Volume 34 – Issue 2 – p 76–86
- Vleeming A, et al. The sacroiliac joint: an overview of its anatomy, function and potential clinical implications. J Anat. 2012 Dec;221(6):537-67
- Murakami E, et al. Leg symptoms associated with sacroiliac joint disorder and related pain. Clin Neurol Neurosurg. 2017 Jun;157:55-58
- Szadek KM, et al. Possible Nociceptive Structures in the Sacroiliac Joint Cartilage: An Immunohistochemical Study. Clin Anat. 2010 Mar;23(2):192-8
- Berthelot JM, et al. Provocative sacroiliac joint maneuvers and sacroiliac joint block are unreliable for diagnosing sacroiliac joint pain. Joint Bone Spine. 2006 Jan;73(1):17-23
- Vanelderen P, et al. 13. Sacroiliac joint pain. Pain Pract. 2010 Sep-Oct;10(5):470-8
- Fortin JD, et al. Sacroiliac joint: pain referral maps upon applying a new injection/arthrography technique. Part I: Asymptomatic volunteers. Spine (Phila Pa 1976). 1994 Jul 1;19(13):1475-82
- Dreyfuss P, et al. Sacroiliac joint pain. J Am Acad Orthop Surg. 2004 Jul-Aug;12(4):255-65
- Slipman CW, et al. Sacroiliac joint pain referral zones. Arch Phys Med Rehabil. 2000 Mar;81(3):334-8
- van der Wurff P, Buijs EJ, Groen GJ. Intensity Mapping of Pain Referral Areas In Sacroiliac Joint Pain Patients. J Manipulative Physiol Ther. 2006 Mar-Apr;29(3):190-5
- Young S, Aprill C, Laslett M. Correlation of clinical examination characteristics with three sources of chronic low back pain. Spine J. 2003 Nov-Dec;3(6):460-5
- Grimm BD, et al. Mimickers of lumbar radiculopathy. J Am Acad Orthop Surg. 2015 Jan;23(1):7-1
- Gellhorn AC, et al. Osteoarthritis of the spine: the facet joints. Nat. Rev. Rheumatol. 9, 216–224 (2013)
- Lesher JM et al. Hip joint pain referral patterns: a descriptive study. Pain Med. 2008 Jan-Feb;9(1):22-5
- Kim HG, et al. Clinical and Radiological Findings of Discogenic Low Back Pain Confirmed by Automated Pressure-Controlled Discography. J Korean Neurosurg Soc. 2009 Oct; 46(4): 333–339
- Bogduk N. On the definitions and physiology of back pain, referred pain, and radicular pain. PAIN 147 (2009) 17–19
- Dreyfuss P, et al. The value of medical history and physical examination in diagnosing sacroiliac joint pain. Spine. 1996 Nov 15;21(22):2594–602
- Hartvigsen J et al. What low back pain is and why we need to pay attention. Lancet. 2018 Jun 9;391(10137):2356-2367
- Feldtkeller E, Rudwaleit M, Zeidler H. Easy probability estimation of the diagnosis of early axial spondyloarthritis by summing up scores. Rheumatology (Oxford). 2013 Sep;52(9):1648-50
- Baraliakos X, Maksymowych WP, Imaging in the diagnosis and management of axial spondyloarthritis, Best Practice & Research Clinical Rheumatology (2016)
- Eno JJ et al. The prevalence of sacroiliac joint degeneration in asymptomatic adults. J Bone Joint Surg Am. 2015 Jun 3;97(11):932-6
Laisser un commentaire